دوره NGS منتشر شد …

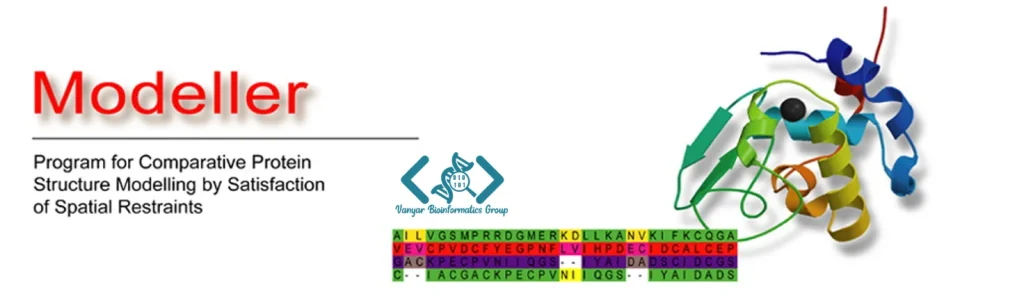
نرم افزار Modeller یکی از قدیمیترین و در عین حال کارآمدترین ابزارهای کامپیوتری برای مدلسازی همولوژی پروتئینها محسوب میشود که توسط پروفسور آندری سالی در دانشگاه کالیفرنیا، سانفرانسیسکو (UCSF) توسعه یافته است.
مدلسازی همولوژی یا مدلسازی مقایسهای بر این اصل استوار است که پروتئینهایی با توالیهای آمینواسیدی مشابه، ساختارهای سهبعدی مشابهی نیز دارند. این رویکرد به محققان امکان میدهد تا با استفاده از ساختار شناختهشده یک پروتئین (الگو)، ساختار پروتئینی با توالی مشابه اما ساختار نامشخص (هدف) را پیشبینی کنند. نرم افزار Modeller با بیش از ۳۰ سال سابقه، استانداردی طلایی در مدلسازی همولوژی محسوب میشود و در هزاران مقاله علمی مورد استناد قرار گرفته است.
نرم افزار Modeller در اوایل دهه ۱۹۹۰ توسط آندری سالی و همکارانش در آزمایشگاه Šali معرفی شد. اولین نسخه این نرمافزار در سال ۱۹۹۳ منتشر گردید و مقاله بنیادی آن در مجله معتبر Journal of Molecular Biology به چاپ رسید. از آن زمان تاکنون، Modeller به طور مداوم بهروزرسانی شده و قابلیتهای جدیدی به آن اضافه شده است. این نرمافزار ابتدا به زبان FORTRAN نوشته شده بود، اما در نسخههای بعدی با رابط پایتون ارائه شد که انعطافپذیری و قابلیت توسعه آن را به شکل چشمگیری افزایش داد.
رویکرد منحصربهفرد Modeller در استفاده از روش “” (satisfaction of spatial restraints) است. در این روش، مجموعهای از محدودیتهای هندسی از ساختار الگو استخراج شده و به توالی هدف اعمال میشود. این محدودیتها شامل فواصل اتمی، زوایای پیوندی، زوایای دوسطحی و دیگر ویژگیهای هندسی است که باید در ساختار نهایی رعایت شوند. سپس الگوریتم بهینهسازی Modeller، ساختاری را تولید میکند که این محدودیتها را تا حد امکان برآورده سازد.
مدلسازی همولوژی بر پایه دو اصل کلیدی استوار است. اول اینکه ساختار پروتئین نسبت به توالی آن محافظتشدهتر است؛ یعنی حتی زمانی که توالیهای دو پروتئین تفاوتهای قابل توجهی دارند، ساختار کلی آنها میتواند مشابه باشد. دوم اینکه هرچه شباهت توالی بین پروتئین هدف و الگو بیشتر باشد، دقت مدل نهایی نیز بالاتر خواهد بود. به طور کلی، شباهت توالی بالای ۳۰٪ معمولاً برای تولید مدلهای قابل اعتماد ضروری است، هرچند در موارد خاص با شباهت کمتر نیز میتوان مدلهای معنادار تولید کرد.
فرآیند مدلسازی همولوژی در Modeller شامل چهار مرحله اصلی است: شناسایی و انتخاب ساختارهای الگو، همترازی توالی هدف با الگو(ها)، ساخت مدل سهبعدی بر اساس محدودیتهای فضایی، و در نهایت ارزیابی و اعتبارسنجی مدل. قدرت Modeller در توانایی آن برای اجرای تمام این مراحل در یک چارچوب یکپارچه و با دقت بالاست.
نرم افزار Modeller برای سیستمعاملهای مختلف شامل ویندوز، لینوکس و مکاواس قابل دسترس است. برای نصب این نرمافزار، ابتدا نیاز به دریافت مجوز آکادمیک رایگان از وبسایت رسمی Modeller دارید. پس از ثبتنام و دریافت کلید مجوز، میتوانید نسخه مناسب با سیستمعامل خود را دانلود کنید. پیشنیاز اصلی برای اجرای Modeller، پایتون نسخه 2.7 یا بالاتر است، هرچند برای بهرهبرداری از تمامی قابلیتهای جدید، پایتون 3.x توصیه میشود. همچنین کتابخانههای NumPy، Biopython و Matplotlib برای کارکرد بهینه و تجزیه و تحلیل نتایج مفید خواهند بود.
با گذشت زمان، نسخههای مختلفی از Modeller عرضه شدهاند که هر کدام قابلیتهای جدیدی را ارائه میکنند. در حال حاضر، نسخه 10.x جدیدترین نسخه در دسترس است که علاوه بر بهبود الگوریتمهای مدلسازی، امکانات جدیدی برای مدلسازی لوپها، ارزیابی مدل و بهینهسازی ساختار ارائه میدهد. نکته مهم در انتخاب نسخه، سازگاری آن با نسخه پایتون مورد استفاده شماست.
نصب Modeller در سیستمهای مختلف تفاوتهای جزئی دارد. در ویندوز، میتوانید از فایل نصبکننده گرافیکی استفاده کنید که اکثر تنظیمات را به طور خودکار انجام میدهد. در سیستمهای لینوکس و مک، معمولاً نصب از طریق خط فرمان انجام میشود. یک روش ساده و توصیه شده، نصب از طریق مدیر بسته Conda است که برای سیستم عاملهای ویندوز، مک و لینوکس در دسترس میباشد. پس از نصب، باید کلید مجوز دریافت شده را در فایل پیکربندی Modeller وارد کنید.
Modeller با مجموعهای از فرمتهای استاندارد در بیوانفورماتیک ساختاری کار میکند. فایلهای ورودی اصلی شامل فایلهای توالی (با فرمت FASTA یا PIR)، فایلهای ساختار الگو (معمولاً با فرمت PDB)، و فایلهای همترازی (با فرمت PIR یا ALI) هستند. فرمت PIR یک فرمت خاص است که در Modeller برای نمایش همترازیها استفاده میشود و شامل اطلاعاتی درباره توالیها و ساختارهای الگو است. فایلهای خروجی اصلی Modeller، مدلهای پروتئینی با فرمت PDB هستند که میتوانند در نرمافزارهای مختلف برای تجسم و تحلیل بیشتر استفاده شوند.
علاوه بر فایلهای ورودی و خروجی، فایلهای اسکریپت پایتون نقش مهمی در کار با Modeller دارند. این اسکریپتها حاوی دستورالعملهای لازم برای اجرای فرآیند مدلسازی هستند و پارامترهای مختلف مانند تعداد مدلهای تولیدی، سطح بهینهسازی، و استراتژیهای ارزیابی را تعیین میکنند. Modeller همچنین فایلهای گزارشی تولید میکند که حاوی اطلاعات مفصلی درباره فرآیند مدلسازی، امتیازات انرژی و آمارههای کیفیت مدل هستند.
فرآیند مدلسازی با Modeller شامل چندین مرحله کلیدی است. مرحله اول، انتخاب ساختارهای الگو مناسب است. این کار معمولاً با جستجوی توالی هدف در پایگاهدادههایی مانند PDB با استفاده از ابزارهایی مانند BLAST یا HHpred انجام میشود. معیارهای انتخاب الگو شامل درصد شباهت توالی، کیفیت ساختاری الگو (قدرت تفکیک کریستالوگرافی)، و تشابه شرایط فیزیولوژیکی و عملکردی است. توصیه میشود برای دستیابی به بهترین نتیجه، از چندین الگو با کیفیت بالا استفاده شود.
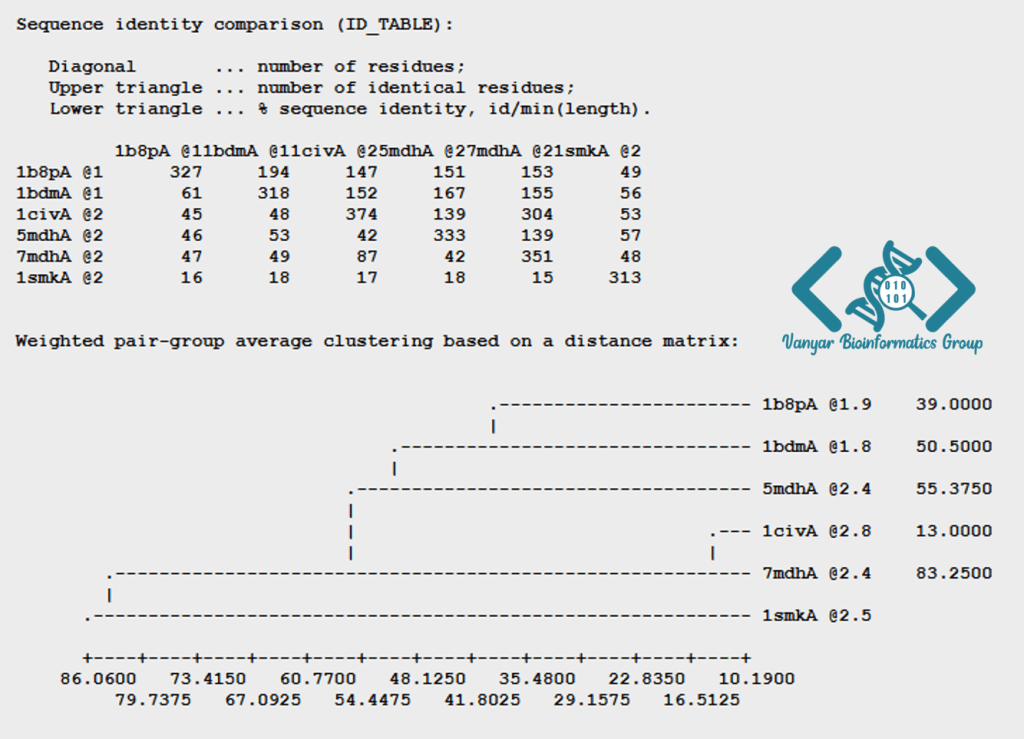
مرحله دوم، همترازی دقیق توالی هدف با توالی الگو(ها) است. این همترازی میتواند با استفاده از ابزارهای همترازی مانند Clustal Omega یا MUSCLE انجام شود، اما اغلب نیاز به اصلاحات دستی دارد تا عناصر ساختاری مهم مانند صفحات بتا و مارپیچهای آلفا به درستی همتراز شوند. کیفیت همترازی تأثیر مستقیمی بر دقت مدل نهایی دارد، بنابراین این مرحله بسیار حیاتی است. Modeller ابزارهایی برای بهبود و ارزیابی همترازیها ارائه میدهد.

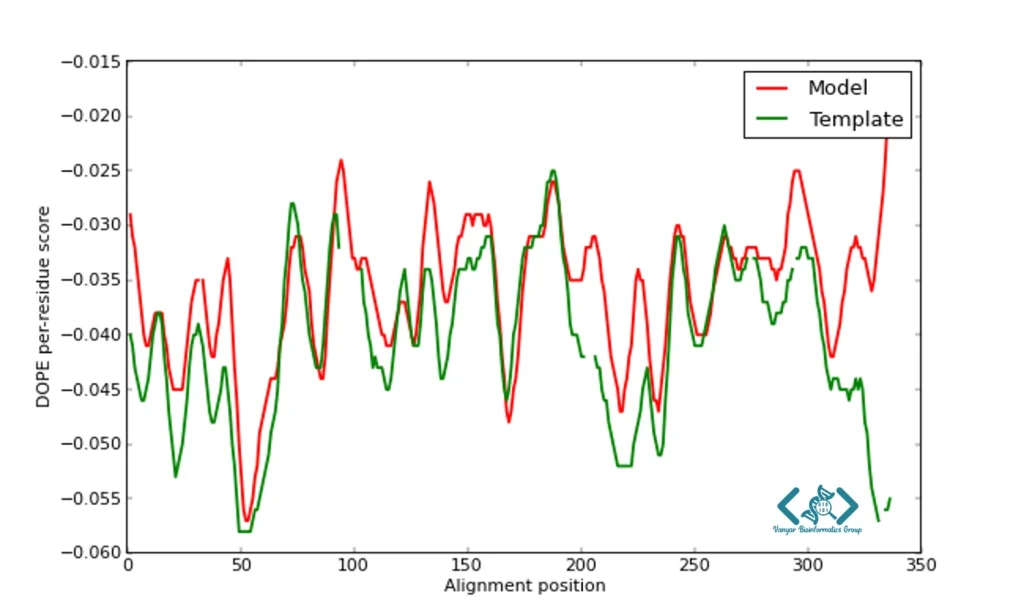
مرحله سوم، تولید مدلهای سهبعدی است که با اجرای اسکریپت Modeller و براساس محدودیتهای فضایی استخراج شده از همترازی انجام میشود. معمولاً چندین مدل (معمولاً بین 5 تا 100 مدل) تولید میشود تا فضای کنفورماسیونی پروتئین به خوبی نمونهبرداری شود. هر مدل از نظر تابع هدف DOPE (Discrete Optimized Protein Energy) و سایر معیارهای کیفیت ارزیابی میشود. در نهایت، مدلهای تولید شده باید از نظر کیفیت استریوشیمیایی و میزان انطباق با اصول بیوفیزیکی ارزیابی شوند.
مدلسازی چندالگویی یکی از قابلیتهای قدرتمند Modeller است که به محققان امکان میدهد از چندین ساختار الگو به طور همزمان برای بهبود دقت مدلسازی استفاده کنند. این رویکرد زمانی مفید است که هیچ ساختار الگوی منفردی تمام ویژگیهای مورد نیاز برای مدلسازی دقیق پروتئین هدف را نداشته باشد. به عنوان مثال، ممکن است یک الگو شباهت توالی بالایی با بخشی از پروتئین هدف داشته باشد، در حالی که الگوی دیگر برای بخش دیگری مناسبتر باشد. در این موارد، Modeller میتواند محدودیتهای فضایی را از تمام الگوها استخراج کرده و آنها را با وزندهی مناسب ترکیب کند.
انتخاب مجموعه مناسبی از الگوها برای مدلسازی چندالگویی چالشبرانگیز است. از یک سو، استفاده از الگوهای بیشتر میتواند اطلاعات ساختاری غنیتری فراهم کند، اما از سوی دیگر، اگر برخی الگوها کیفیت پایینی داشته باشند یا با یکدیگر ناسازگار باشند، میتوانند باعث افزایش خطا شوند. یک استراتژی معمول، استفاده از یک الگوی اصلی با بیشترین شباهت کلی و سپس افزودن الگوهای تکمیلی برای بهبود مدلسازی نواحی خاص است. Modeller الگوریتمهایی برای تشخیص و حل تعارضات احتمالی بین محدودیتهای فضایی حاصل از الگوهای مختلف ارائه میدهد.
لوپها نواحی انعطافپذیر پروتئینها هستند که معمولاً در سطح قرار دارند و ساختار منظمی (مانند مارپیچ آلفا یا صفحه بتا) ندارند. مدلسازی دقیق این نواحی یکی از چالشبرانگیزترین جنبههای پیشبینی ساختار پروتئین است، زیرا لوپها دارای تنوع کنفورماسیونی بالایی هستند و حتی در پروتئینهای همولوگ میتوانند تفاوتهای قابل توجهی داشته باشند. Modeller دارای ماژول مخصوصی برای مدلسازی لوپ است که از دو روش اصلی استفاده میکند: نمونهبرداری کنفورماسیونی و بهینهسازی انرژی.
بسیاری از پروتئینها برای عملکرد صحیح خود به کوفاکتورها (مانند یونهای فلزی) یا لیگاندها (مانند سوبستراها، مهارکنندهها، یا مولکولهای کوچک) نیاز دارند. مدلسازی صحیح این تعاملات برای درک مکانیسم عملکرد پروتئین و طراحی دارو ضروری است. Modeller امکان گنجاندن لیگاندها و کوفاکتورها در فرآیند مدلسازی را فراهم میکند. برای این کار، ابتدا باید لیگاند در ساختار الگو شناسایی شده و پارامترهای لازم برای توصیف آن تعریف شود. سپس Modeller میتواند محدودیتهای فضایی مربوط به برهمکنشهای لیگاند-پروتئین را در مدلسازی لحاظ کند.
یکی از چالشهای این روش، تعریف صحیح پارامترهای میدان نیرو برای لیگاندهای غیراستاندارد است. Modeller به طور پیشفرض پارامترهای استاندارد برای آمینواسیدها، نوکلئوتیدها و برخی کوفاکتورهای رایج دارد، اما برای لیگاندهای اختصاصی، ممکن است نیاز به تعریف دستی پارامترها باشد. همچنین، در موارد پیچیدهتر که تغییرات کنفورماسیونی قابل توجهی در اثر اتصال لیگاند رخ میدهد، ممکن است نیاز به ترکیب Modeller با روشهای پیشرفتهتری مانند داکینگ مولکولی یا شبیهسازی دینامیک مولکولی باشد.
با ظهور روشهای مبتنی بر یادگیری عمیق مانند AlphaFold2 و RoseTTAFold، چشمانداز پیشبینی ساختار پروتئین به طور اساسی تغییر کرده است. این روشها که از شبکههای عصبی عمیق برای یادگیری الگوهای تکاملی و فیزیکی در دادههای پروتئینی استفاده میکنند، در بسیاری موارد دقت قابل توجهی نسبت به روشهای سنتی مانند مدلسازی همولوژی نشان میدهند. AlphaFold2 به خصوص در رقابت CASP14 (ارزیابی جهانی روشهای پیشبینی ساختار پروتئین) نتایج فوقالعادهای کسب کرد و در بسیاری موارد، مدلهایی با دقت نزدیک به ساختارهای آزمایشگاهی تولید کرد.
با این حال، Modeller همچنان جایگاه مهمی در مدلسازی پروتئین دارد. اول، رویکرد مبتنی بر اصول فیزیکی و دانش ساختاری Modeller، شفافیت و قابلیت تفسیر بیشتری نسبت به جعبه سیاه یادگیری عمیق دارد. دوم، انعطافپذیری Modeller در ترکیب انواع دادههای تجربی و محدودیتهای سفارشی همچنان یک مزیت است. سوم، برای کاربردهای خاص مانند مدلسازی هدفمند کمپلکسها، لوپهای متنوع، و پروتئینهای با ویژگیهای غیرمعمول، روشهای سنتی مانند Modeller همچنان کاربرد دارند.
در حقیقت، ترکیب روشهای یادگیری عمیق و روشهای سنتی یک رویکرد قدرتمند است. به عنوان مثال، میتوان از مدلهای AlphaFold2 به عنوان الگو در Modeller استفاده کرد یا از Modeller برای پالایش و بهبود مدلهای حاصل از AlphaFold2 بهره برد. این رویکرد ترکیبی، مزایای هر دو روش را با هم ترکیب میکند.
با وجود پیشرفتهای چشمگیر در روشهای یادگیری عمیق، نرم افزار Modeller همچنان در حال توسعه است و انتظار میرود در آینده، قابلیتهای جدیدی به آن اضافه شود. یکی از مسیرهای احتمالی توسعه، ادغام الگوریتمهای یادگیری ماشین در چارچوب Modeller برای بهبود دقت پیشبینی است. همچنین، گسترش قابلیتهای مدلسازی کمپلکسهای پروتئین-پروتئین و پروتئین-اسید نوکلئیک از دیگر زمینههای توسعه احتمالی است.
توسعه رابط کاربری گرافیکی برای Modeller نیز میتواند دسترسی به این نرمافزار را برای کاربران غیرمتخصص در برنامهنویسی تسهیل کند. همچنین، بهبود یکپارچهسازی با سایر ابزارهای بیوانفورماتیک و پلتفرمهای محاسباتی ابری میتواند کاربردپذیری Modeller را افزایش دهد. با توجه به روند فزاینده تولید دادههای ژنومیکی، توانایی مدلسازی خودکار و با مقیاس بالا نیز از نیازهای آینده خواهد بود.
در نهایت، نقش Modeller در آینده احتمالاً به سمت یک ابزار تخصصی برای موارد پیچیده و سفارشی تغییر خواهد کرد، جایی که روشهای یادگیری عمیق هنوز به بلوغ کامل نرسیدهاند یا نیاز به دانش و کنترل دقیق فرآیند مدلسازی وجود دارد. با این وجود، اصول علمی و الگوریتمهای بنیادی Modeller همچنان بخش مهمی از زیرساخت علمی بیوانفورماتیک ساختاری خواهند بود.
نرم افزار Modeller با بیش از سه دهه سابقه، همچنان یکی از مهمترین و پرکاربردترین ابزارهای مدلسازی ساختار پروتئین است. قدرت این نرمافزار در رویکرد علمی آن، انعطافپذیری، قابلیت سفارشیسازی، و یکپارچگی با سایر ابزارهای بیوانفورماتیک نهفته است. از مدلسازی ساده پروتئینهای تکدامین تا چالشهای پیچیدهتر مانند مدلسازی پروتئینهای غشایی، کمپلکسهای پروتئینی و کمپلکسهای پروتئین-لیگاند، Modeller طیف وسیعی از کاربردهای تحقیقاتی را پوشش میدهد.
با ظهور روشهای یادگیری عمیق، چشمانداز پیشبینی ساختار پروتئین در حال تغییر است. با این حال، درک عمیق اصول و روشهای مدلسازی همولوژی که در Modeller پیادهسازی شدهاند، همچنان برای متخصصان بیوانفورماتیک و بیولوژی ساختاری ضروری است. ترکیب روشهای سنتی مانند Modeller با رویکردهای نوین یادگیری عمیق، راهکاری امیدبخش برای آینده پیشبینی ساختار پروتئین است.
در نهایت، هر چند تکنولوژیهای جدید مرزهای علم را گسترش میدهند، دانش و درک اصول پایه همواره ارزشمند خواهد بود. Modeller نه تنها یک ابزار کاربردی، بلکه یک پلتفرم آموزشی مهم برای درک اصول بیوفیزیکی، تکاملی و محاسباتی حاکم بر ساختار پروتئینها است. با درک عمیق این اصول و تسلط بر ابزارهای مدلسازی مانند Modeller، محققان میتوانند به بینشهای ارزشمندی درباره رابطه توالی، ساختار و عملکرد پروتئینها دست یابند که اساس بسیاری از پیشرفتها در علوم زیستی و پزشکی است.
Modeller یک نرمافزار قدرتمند برای مدلسازی همولوژی یا مدلسازی مقایسهای ساختار سهبعدی پروتئینها است. این ابزار به محققان اجازه میدهد ساختار پروتئینهایی را که ساختار تجربی آنها مشخص نیست، با استفاده از ساختارهای شناختهشده و شباهت توالی پیشبینی کنند. Modeller بهطور گسترده در تحقیقات بیوانفورماتیک، بیولوژی ساختاری و طراحی دارو استفاده میشود.
Modeller از یک رویکرد مبتنی بر محدودیتهای فضایی استفاده میکند. ابتدا توالی پروتئین هدف با توالی پروتئینهای الگو همتراز میشود. سپس اطلاعات ساختاری الگو به شکل محدودیتهای فضایی استخراج میشود و یک الگوریتم بهینهسازی ساختاری این محدودیتها را بر توالی هدف اعمال کرده و مدل سهبعدی را تولید میکند.
بله، برای استفادههای آکادمیک و تحقیقاتی رایگان است. با این حال، برای استفاده تجاری نیاز به خرید مجوز دارید.
برای نصب، ابتدا باید مجوز رایگان آکادمیک را از وبسایت رسمی نرمافزار دریافت کنید. پس از دریافت کلید مجوز، نرمافزار را دانلود و نصب کنید. Modeller برای اجرا به Python نیاز دارد و نصب کتابخانههایی مانند NumPy و Biopython توصیه میشود. نصب در ویندوز، لینوکس و macOS امکانپذیر است.

تیم تولید محتوای گروه بیوانفورماتیک وانیار در تلاش است تا بهترین آموزشهای کوتاه در زمینه بیوانفورماتیک و زیستشناسی را تهیه نماید. صحت محتوای این صفحه توسط کارشناسان گروه بیوانفورماتیک وانیار بررسی شده است.
عضویت در مجله وانیار
جدید ترین مقالات در ایمیل شما!
با عضویت در مجله بیوانفورماتیک وانیار ، برترین مقالات را در ایمیل خود دریافت کنید.
سلام، وقت بخیر.
چطور میتونیم بهتون کمک کنیم؟ 🤓
تیم ما آماده پاسخگویی به سوالات شماست.
پشتیبانی 24 ساعته در 7 روز هفته.