دوره NGS منتشر شد …

الکتروفورز پروتئین یکی از تکنیکهای اساسی و کاربردی در علم بیوشیمی، بیولوژی مولکولی و تشخیص بالینی محسوب میشود. این روش بر اساس حرکت پروتئینها در یک میدان الکتریکی و جداسازی آنها بر اساس خصوصیات فیزیکوشیمیایی مانند وزن مولکولی، بار الکتریکی و شکل فضایی استوار است.امروزه با پیشرفت فناوری، نرم افزارهای متعددی برای آنالیز نتایج الکتروفورز پروتئین توسعه یافتهاند که امکان تفسیر دقیق، کمیسازی و مقایسه الگوهای الکتروفورتیک را فراهم میکنند. این نرم افزارها نقش مهمی در افزایش دقت، تکرارپذیری و سرعت آنالیز نتایج الکتروفورز ایفا میکنند.
در این مقاله جامع، به بررسی مبانی الکتروفورز پروتئین، معرفی نرم افزارهای مختلف، کاربردهای بالینی و تحقیقاتی، چالشها و آینده این حوزه خواهیم پرداخت.
الکتروفورز به عنوان یک روش جداسازی بیومولکولها برای اولین بار در اوایل قرن بیستم توسط آرنیوس معرفی شد، اما کاربرد گسترده آن در جداسازی پروتئینها به دهه ۱۹۳۰ و کارهای تیسلیوس برمیگردد که منجر به دریافت جایزه نوبل شیمی در سال ۱۹۴۸ شد. در دهههای بعدی، پیشرفتهای قابل توجهی در این تکنیک به وجود آمد، از جمله معرفی الکتروفورز ژل پلیاکریلآمید توسط ریموند و وینگراد در سال ۱۹۵۹ و توسعه SDS-PAGE توسط لملی در سال ۱۹۷۰ که انقلابی در جداسازی پروتئینها بر اساس وزن مولکولی ایجاد کرد.
با گذر زمان، روشهای پیشرفتهتری همچون الکتروفورز دو بعدی، الکتروفورز مویینه و ایزوالکتریک فوکوسینگ توسعه یافتند که امکان جداسازی پیچیدهتر و دقیقتر پروتئینها را فراهم کردند. موازی با این پیشرفتها، نیاز به ابزارهای کامپیوتری برای آنالیز نتایج نیز افزایش یافت. اولین نرمافزارهای آنالیز الکتروفورز در دهه ۱۹۸۰ با قابلیتهای محدود ظهور کردند، اما با پیشرفت بیوانفورماتیک و دانش پردازش تصویر، امروزه نرم افزارهای قدرتمندی در دسترس قرار دارند که قادر به تشخیص خودکار باندها، کمیسازی دقیق و آنالیزهای آماری پیشرفته هستند.
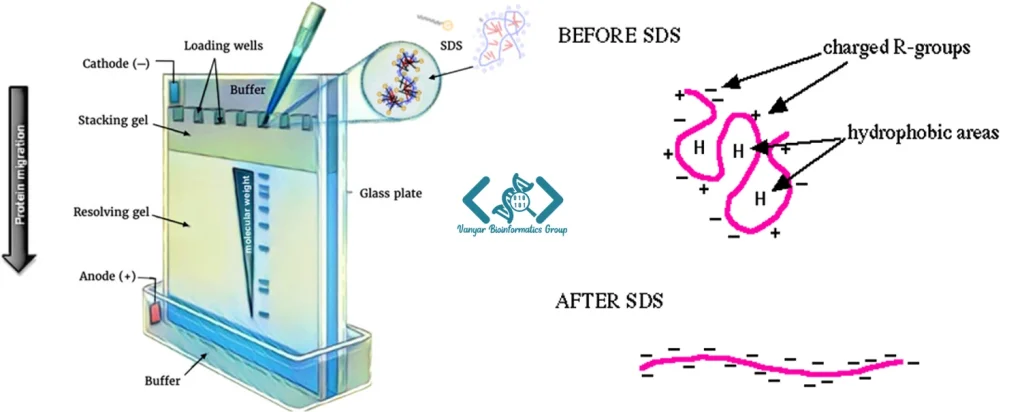
الکتروفورز پروتئین به روشهای متنوعی انجام میشود که هر کدام برای هدف خاصی بهینه شدهاند. رایجترین نوع آن، SDS-PAGE (الکتروفورز ژل پلیاکریلآمید-سدیم دودسیل سولفات) است که در آن پروتئینها پس از دناتوره شدن با SDS، صرفاً بر اساس وزن مولکولی جداسازی میشوند. در این روش، SDS با ایجاد بار منفی یکنواخت روی تمام پروتئینها، اثر بار ذاتی پروتئین را حذف میکند و تفکیک تنها بر اساس اندازه صورت میگیرد.
الکتروفورز نیتیو (بومی) که بدون استفاده از عوامل دناتورهکننده انجام میشود، امکان بررسی پروتئینها در حالت طبیعی و حفظ فعالیت آنزیمی را فراهم میکند. الکتروفورز دو بعدی ترکیبی از ایزوالکتریک فوکوسینگ (جداسازی بر اساس نقطه ایزوالکتریک) در بعد اول و SDS-PAGE در بعد دوم است که قدرت تفکیک بسیار بالایی دارد و برای مطالعات پروتئومیکس بسیار ارزشمند است.
روشهای دیگر مانند الکتروفورز مویینه (CE) و الکتروفورز پالسی (PFGE) نیز برای کاربردهای خاص توسعه یافتهاند. هر کدام از این روشها نیازمند نرم افزارهای تخصصی برای آنالیز نتایج هستند که قابلیتهای متفاوتی برای پردازش دادههای حاصل از آنها ارائه میدهند.
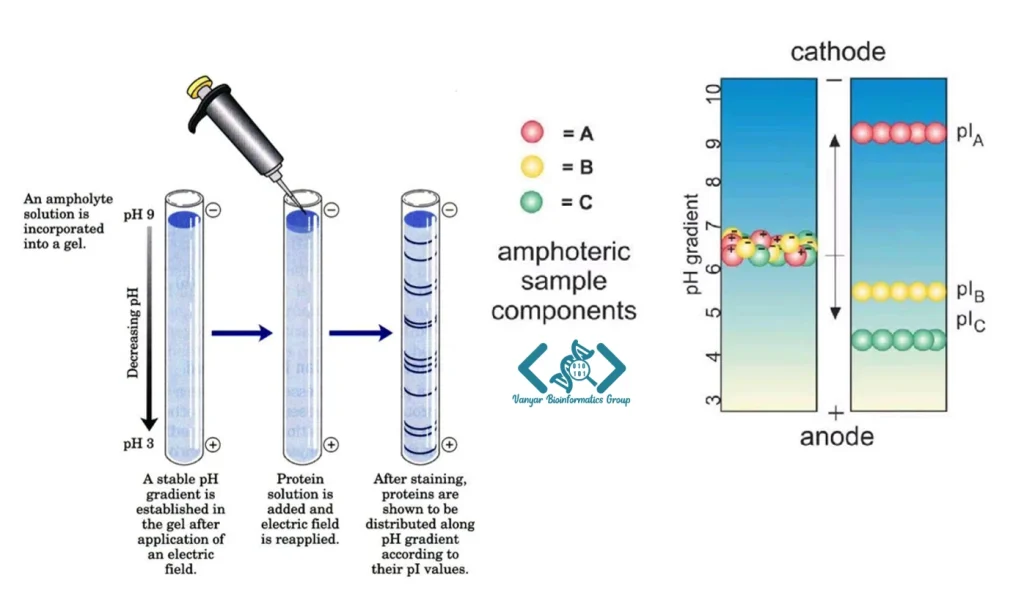
روشی دقیق برای جداسازی پروتئینها بر اساس نقطه ایزوالکتریک (pI) آنهاست؛ یعنی pHای که در آن بار الکتریکی خالص پروتئین صفر میشود. در این روش، پروتئینها در یک گرادیان pH ایجادشده توسط آمفولیتها یا ژلهای با pH تثبیتشده (IPG) Immobilized pH Gradient قرار میگیرند و تحت تأثیر میدان الکتریکی، تا رسیدن به ناحیهای با pH برابر با pI خود مهاجرت میکنند. در این نقطه، پروتئینها فاقد بار شده و متوقف میشوند. IEF بهعنوان یک فناوری با رزولوشن بالا، قادر است حتی ایزوفرمهای پروتئینی با تفاوتهای جزئی در بار (مانند تغییرات پساترجمهای) را تفکیک کند. این روش بهطور گسترده در پروتئومیکس، کنترل کیفیت داروهای بیولوژیک و تشخیص بیماریها (مانند شناسایی هموگلوبینهای غیرطبیعی) کاربرد دارد و اغلب بهعنوان مرحله اول در الکتروفورز دوبُعدی (2D-PAGE) استفاده میشود. نیاز به آمادهسازی دقیق نمونه و بهینهسازی شرایط آزمایش از چالشهای این تکنیک محسوب میشوند.
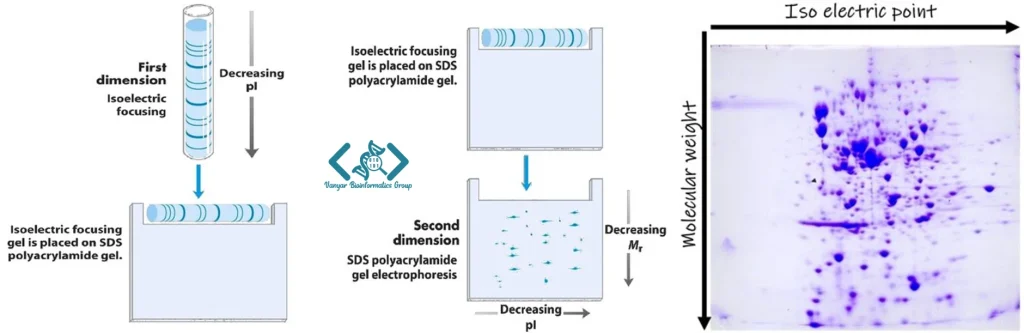
الکتروفورز دو بعدی پروتئین یک روش پیشرفته در حوزه پروتئومیکس است که جهت جداسازی دقیق پروتئینها به کار میرود. در این تکنیک، ابتدا نمونهها را با استفاده از ایزوالکتریک فوکوسینگ (IEF) بر اساس نقطه ایزوالکتریک جدا میکنند و سپس در بعد دوم با ژل SDS-PAGE پروتئینها بر اساس وزن مولکولی تفکیک میشوند. این دو بعد جداگانه باعث میشود تا حتی تغییرات ناچیز در ساختار یا تغییرات پس از ترجمهای مانند فسفریلاسیون و گلیکوزیلاسیون نیز شناسایی شوند. در نتیجه، الکتروفورز دو بعدی نه تنها الگوهای پیچیده پروتئینی را به وضوح نمایش میدهد، بلکه به پژوهشگران در کشف تفاوتهای بیولوژیکی و بیماریزایی کمک شایانی میکند. این روش با ارائه دقت بالا، کاهش تداخل و امکان تحلیل گسترده، به یکی از ابزارهای ضروری در مطالعات بالینی و بنیادی تبدیل شده است.
الکتروفورز مویینه (CE) پروتئینها یک روش پیشرفته جهت جداسازی و تحلیل دقیق مولکولهای پروتئینی است که در آن نمونهها در داخل مویینههای فوقالعاده باریک تحت تأثیر میدان الکتریکی قوی قرار میگیرند. این فرایند باعث میشود پروتئینها بر اساس بار و اندازه خود بهصورت دقیق از یکدیگر تفکیک شوند. نتایج حاصله از این تکنیک با دقت بالا ارائه میشود که امکان تشخیص تغییرات ساختاری و عملکردی در پروتئینها را فراهم میآورد. به همین منظور، الکتروفورز مویینه نقش مهمی در تحقیقات زیستفناوری، تشخیص زودهنگام بیماریها و تحلیل محیطهای پیچیده زیستی ایفا میکند. کاربرد این روش علاوه بر سرعت بالا، از اهمیت ویژهای برخوردار بوده و با مصرف نمونه کم، بازدهی آزمایشگاهها را افزایش میدهد. به طور کلی، بهرهمندی از الکتروفورز مویینه به عنوان یک ابزار اساسی در مطالعات پیشرفته علمی، نویدبخش آیندهای روشن در تشخیص و درمان بیماریها محسوب میشود.
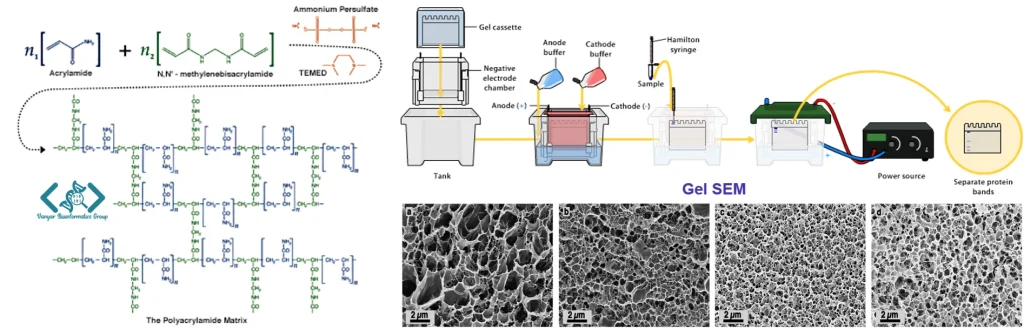
جداسازی پروتئینها در الکتروفورز بر اساس اصل بنیادی حرکت ذرات باردار در میدان الکتریکی استوار است. سرعت حرکت یک پروتئین در میدان الکتریکی (موبیلیتی الکتروفورتیک) تابعی از نسبت بار به جرم آن است. پروتئینها به عنوان مولکولهای آمفوتریک، بسته به pH محیط دارای بار خالص مثبت یا منفی هستند و در نقطه ایزوالکتریک خود بار خالص صفر دارند.
در SDS-PAGE، دترجنت SDS به ازای هر دو اسید آمینه تقریباً یک مولکول به پروتئین متصل میشود و بار منفی یکنواختی به آن میدهد. بدین ترتیب، نسبت بار به جرم برای همه پروتئینها تقریباً یکسان شده و جداسازی عمدتاً تحت تأثیر اثر غربال مولکولی ژل قرار میگیرد. در این حالت، پروتئینهای کوچکتر سریعتر از ماتریکس ژل عبور میکنند، در حالی که پروتئینهای بزرگتر حرکت کندتری دارند.
فاکتورهای دیگری نظیر غلظت ژل، شدت میدان الکتریکی، درجه حرارت و ترکیب بافر نیز بر جداسازی تأثیرگذار هستند. نرم افزارهای پیشرفته الکتروفورزمیتوانند این پارامترها را در نظر بگیرند تا نتایج دقیقتری از تحلیل الگوهای الکتروفورتیک ارائه دهند و حتی برخی از آنها امکان شبیهسازی شرایط بهینه را قبل از انجام آزمایش واقعی فراهم میکنند.
امروزه نرم افزارهای تجاری متعددی برای آنالیز نتایج الکتروفورز پروتئین در دسترس هستند که هر کدام ویژگیها و قابلیتهای منحصر به فردی دارند. یکی از پیشگامان این حوزه، نرم افزار Bio-Rad’s Image Lab است که با سیستمهای تصویربرداری این شرکت یکپارچه میباشد و امکان آنالیز خودکار باندها، کمیسازی دقیق و تولید گزارشهای جامع را فراهم میکند. این نرم افزار دارای الگوریتمهای پیشرفته تشخیص لبه و حذف پسزمینه است که دقت اندازهگیری را به طور قابل توجهی افزایش میدهد.
TotalLab Quant از دیگر نرم افزارهای قدرتمند است که علاوه بر ژلهای یک بعدی، قابلیت آنالیز ژلهای دو بعدی، وسترن بلات و آرایهها را نیز دارد. امکان آنالیز چندین ژل به صورت همزمان و قابلیت نرمالسازی بین ژلها از ویژگیهای مهم این نرم افزار است. GelAnalyzer Pro نیز با رابط کاربری ساده و کارآمد، امکان آنالیز سریع ژلها را با دقت بالا فراهم میکند و برای آزمایشگاههای کوچک و متوسط گزینه مناسبی محسوب میشود.
CLIQS و CLIQS 2D از شرکت TotalLab نیز با تمرکز بر تحلیلهای آماری پیشرفته و قابلیت استخراج الگوهای بیان پروتئین، برای تحقیقات پروتئومیکس بسیار کارآمد هستند. این نرم افزارها معمولاً هزینه قابل توجهی دارند، اما پشتیبانی فنی، بهروزرسانیهای منظم و قابلیت اطمینان بالا از مزایای آنها به شمار میآید.
در کنار نرم افزارهای تجاری گرانقیمت، گزینههای منبع باز و رایگان قابل توجهی نیز برای آنالیز نتایج الکتروفورز وجود دارند که برای بسیاری از آزمایشگاهها، بهویژه در محیطهای آکادمیک، بسیار ارزشمند هستند. ImageJ یکی از شناختهشدهترین نرم افزارهای آنالیز تصویر است که توسط NIH توسعه یافته و با پلاگینهای متعدد، قابلیتهای جذابی برای آنالیز ژلهای الکتروفورز دارد. پلاگین GelAnalyzer برای ImageJ امکان تشخیص خودکار باندها، اندازهگیری حجم، تراکم و وزن مولکولی پروتئینها را فراهم میکند.
PyElph یک نرم افزار منبع باز نوشته شده با پایتون است که برای آنالیز ژلهای الکتروفورز DNA و پروتئین طراحی شده و از الگوریتمهای هوشمند برای تشخیص باندها استفاده میکند. GelJ نیز یک نرم افزار رایگان جاوا-محور است که قابلیتهای پیشرفتهای برای تصحیح هندسی تصاویر ژل، عادیسازی و خوشهبندی ارائه میدهد.
MELANIE و Delta2D از دیگر نرم افزارهای قدرتمند برای آنالیز ژلهای دو بعدی هستند که نسخههای محدود رایگان نیز ارائه میدهند. این نرم افزارها اگرچه ممکن است برخی از قابلیتهای پیشرفته نرم افزارهای تجاری را نداشته باشند، اما برای بسیاری از کاربردهای معمول کاملاً کافی هستند و میتوانند نتایج قابل اعتمادی ارائه دهند.
انتخاب نرم افزار مناسب برای آنالیز الکتروفورز پروتئین به فاکتورهای متعددی بستگی دارد که باید با توجه به نیازهای خاص هر آزمایشگاه مورد ارزیابی قرار گیرند. یکی از مهمترین معیارها، نوع الکتروفورز مورد استفاده است؛ برخی نرم افزارها مخصوص ژلهای یک بعدی هستند، در حالی که برخی دیگر برای ژلهای دو بعدی بهینه شدهاند. همچنین، قابلیت سازگاری با فرمتهای مختلف تصویری و دستگاههای تصویربرداری موجود در آزمایشگاه از دیگر فاکتورهای مهم است.
دقت و صحت آنالیز، بهویژه در کاربردهای بالینی، اهمیت بسیار بالایی دارد. نرم افزارهای پیشرفته باید از الگوریتمهای قوی برای تشخیص باندها، حذف پسزمینه و تصحیح انحرافات استفاده کنند. قابلیتهای آماری مانند آنالیز واریانس، خوشهبندی و آزمونهای آماری برای مقایسه نمونهها نیز در تحقیقات مقایسهای اهمیت زیادی دارد.
از دیگر معیارهای مهم میتوان به سهولت استفاده، کیفیت مستندات و آموزش، امکان اتوماسیون برای آنالیز حجم بالای نمونهها، قابلیت رهگیری تغییرات و مستندسازی مراحل آنالیز (بهویژه برای آزمایشگاههای دارای استانداردهای ISO)، و امکان برونریزی نتایج در فرمتهای مختلف اشاره کرد. در نهایت، محدودیتهای بودجهای، نیاز به آموزش پرسنل و پشتیبانی فنی نیز باید در تصمیمگیری لحاظ شوند.
ImageJ یکی از پرکاربردترین نرم افزارهای آنالیز تصویر در حوزه علوم زیستی است که به دلیل رایگان بودن، انعطافپذیری بالا و قابلیت توسعه، برای آنالیز ژلهای الکتروفورز نیز بسیار مورد استفاده قرار میگیرد. ImageJ پلاگینهای متنوع و قدرتمندی دارد که قابلیتهای تخصصی برای آنالیز الکتروفورز ارائه میدهند.
پلاگین GelAnalyzer یکی از مهمترین افزونهها برای آنالیز ژلهای الکتروفورز است که امکان تشخیص خودکار مسیرها (lanes) و باندها، کمیسازی شدت باندها و محاسبه وزن مولکولی با استفاده از مارکرهای استاندارد را فراهم میکند. روش کار با این پلاگین نسبتاً ساده است: ابتدا تصویر ژل در ImageJ بارگذاری میشود، سپس با استفاده از ابزار مسیریابی، مسیرهای حرکت پروتئین در ژل مشخص میشوند. پس از آن، پروفایل دانسیتومتری هر مسیر را استخراج کرده و باندها را با استفاده از الگوریتم تشخیص پیک شناسایی میکنند. در نهایت، شدت باندها را محاسبه و گزارش میکنند.
پلاگینهای دیگری مانند Fiji (ImageJ با بستههای پیشنصب)، ColonyArea (برای آنالیز کمّی کلونیها)، و SparkyJ (برای آنالیز ژلهای دو بعدی) نیز در دسترس هستند که قابلیتهای تخصصیتری ارائه میدهند. با وجود رابط کاربری نسبتاً قدیمی، آموزش استفاده از ImageJ برای تازهکاران نسبتاً ساده است و منابع آموزشی متعددی شامل راهنماها، ویدئوها و فورومهای آنلاین برای این نرم افزار وجود دارد.
پیشنهاد میکنیم آموزک SignalP چیست؟ آموزش شناسایی پپتید راهنما با SignalP رو مشاهده کنی.
GelAnalyzer رابط کاربری گرافیکی و سادهای دارد که برای کاربران با هر سطح تخصصی مناسب است. در اینجا، مراحل اصلی کار با این نرم افزار را به صورت گام به گام شرح میدهیم.
پس از اجرای نرم افزار، تصویر ژل را از منوی File > Open Image بارگذاری کنید. سپس میتوانید با استفاده از ابزارهای پردازش تصویر مانند تنظیم روشنایی و کنتراست، افزایش وضوح و حذف نویز، کیفیت تصویر را بهبود بخشید. در این مرحله، امکان چرخش تصویر نیز وجود دارد که برای تصحیح انحراف احتمالی ژل مفید است.
با کلیک بر روی دکمه “Create Lanes” وارد مرحله تعیین مسیرها میشوید. میتوانید به صورت خودکار یا دستی، مسیرهای حرکت پروتئین در ژل را مشخص کنید. در روش خودکار، نرم افزار تلاش میکند مسیرها را شناسایی کند، اما در تصاویر با کیفیت پایین یا ژلهای پیچیده، روش دستی دقیقتر است. پس از تعیین مسیرها، میتوانید عرض و موقعیت آنها را تنظیم کنید.
پس از تعریف مسیرها، با کلیک بر روی دکمه “Detect Bands” وارد مرحله شناسایی باندها میشوید. نرم افزار پروفایل دانسیتومتری هر مسیر را ایجاد کرده و پیکهای آن را به عنوان باند شناسایی میکند. پارامترهای تشخیص مانند حساسیت و سطح آستانه را میتوانید تنظیم کنید تا باندهای ضعیفتر نیز شناسایی شوند. همچنین امکان افزودن یا حذف دستی باندها نیز وجود دارد.
اگر در ژل خود از مارکرهای وزن مولکولی استفاده کردهاید، میتوانید با مشخص کردن مسیر مارکر و وارد کردن وزن مولکولی باندهای آن، منحنی کالیبراسیون ایجاد کنید. سپس نرم افزار وزن مولکولی تقریبی سایر باندها را محاسبه میکند. همچنین میتوانید با استفاده از استانداردهای غلظت، کمیسازی دقیق باندها را انجام دهید.
پس از تکمیل آنالیز، میتوانید نتایج را به صورت گزارشهای متنی، تصویری و نموداری استخراج کنید. اطلاعات کمّی هر باند شامل وزن مولکولی تقریبی، شدت نسبی یا مطلق، مساحت و حجم باند قابل استخراج است. همچنین میتوانید دادهها را در فرمت Excel یا CSV برای آنالیزهای بیشتر ذخیره کنید.
آینده نرم افزارهای الکتروفورز پروتئین با پیشرفتهای فناوری در حوزههای مختلف گره خورده است. یکی از روندهای مهم، توسعه سیستمهای تصویربرداری با قدرت تفکیک بالاتر و حساسیت بیشتر است که امکان تشخیص پروتئینهای با غلظت بسیار کم را فراهم میکند. این پیشرفتها نیازمند نرم افزارهایی با الگوریتمهای پیشرفتهتر برای پردازش تصاویر با حجم دیتای بیشتر و دقت بالاتر هستند.
ادغام تکنیکهای مختلف آنالیز پروتئین مانند الکتروفورز، اسپکترومتری جرمی، و روشهای ایمونولوژیک روند دیگری است که به سمت ایجاد پلتفرمهای یکپارچه پیش میرود. نرم افزارهای آینده باید قادر به مدیریت و تحلیل دادههای حاصل از این روشهای ترکیبی باشند و بتوانند تصویر جامعتری از پروتئوم ارائه دهند. این یکپارچهسازی میتواند به شناسایی دقیقتر پروتئینها، مطالعه تعاملات پروتئین-پروتئین و درک بهتر مسیرهای بیولوژیک منجر شود.
اتوماسیون پیشرفته در تمام مراحل از آمادهسازی نمونه تا آنالیز نتایج نیز روندی است که در آینده شدت خواهد گرفت. سیستمهای کاملاً خودکار با قابلیت مدیریت حجم بالای نمونه و آنالیز خودکار نتایج، نیاز به دخالت انسانی را کاهش، و سرعت و دقت آنالیز را افزایش میدهند. نرم افزارهای این سیستمها باید قادر به مدیریت جریان کار، کنترل کیفیت خودکار و تشخیص خطاها باشند.
هوش مصنوعی و یادگیری ماشین در حال تغییر بنیادی روشهای آنالیز دادههای الکتروفورز پروتئین هستند. الگوریتمهای یادگیری عمیق (Deep Learning) برای تشخیص باندها و لکههای پروتئینی قادرند با دقتی فراتر از روشهای سنتی عمل کنند، به ویژه در شرایط چالشبرانگیز مانند ژلهای با کیفیت پایین، باندهای همپوشان یا پسزمینه نامنظم. شبکههای عصبی کانولوشنی (CNN) که در تشخیص الگو در تصاویر تخصص دارند، میتوانند برای شناسایی خودکار باندها، تصحیح انحرافات و حذف آرتیفکتها استفاده شوند.
الگوریتمهای یادگیری ماشین همچنین میتوانند در تحلیل الگوهای پروتئینی و کشف ارتباط پنهان بین پروفایلهای پروتئینی و فنوتیپهای بیماری بسیار مفید باشند. روشهایی مانند خوشهبندی غیرنظارتی (unsupervised clustering) برای شناسایی گروههای پروتئینی با الگوهای بیان مشابه، و الگوریتمهای طبقهبندی (classification) برای پیشبینی وضعیت بیماری بر اساس پروفایل پروتئینی استفاده میشوند.
یکی دیگر از کاربردهای هوش مصنوعی، بهینهسازی خودکار پارامترهای آنالیز است. الگوریتمهای تکاملی یا روشهای بهینهسازی بیزی میتوانند به طور خودکار بهترین پارامترها را برای هر تصویر ژل تعیین کنند و نیاز به تنظیم دستی را کاهش دهند. همچنین، سیستمهای هوشمند میتوانند با یادگیری از تجربیات قبلی، روشهای آنالیز را به مرور زمان بهبود بخشند و خطاهای رایج را پیشبینی و از آنها جلوگیری کنند.
ترکیب هوش مصنوعی با دانش متخصصان انسانی در قالب سیستمهای خبره (Expert Systems) نیز میتواند به تفسیر دقیقتر نتایج الکتروفورز کمک کند. این سیستمها قادرند با استفاده از پایگاه دانش گسترده و قواعد استنباطی پیچیده، تشخیصهای احتمالی برای الگوهای غیرطبیعی ارائه دهند و به متخصصان در تصمیمگیریهای بالینی کمک کنند.
دریافت جدیدترین اخبار در کانال لینکدین گروه بیوانفورماتیک وانیار
نرم افزارهای الکتروفورز پروتئین نقش حیاتی در دقت، تکرارپذیری و کارآمدی آنالیز نتایج الکتروفورز ایفا میکنند. از نرم افزارهای ساده برای تشخیص باندها و کمیسازی آنها، تا پلتفرمهای پیچیدهتر یکپارچه با قابلیتهای پیشرفته تحلیلی، طیف وسیعی از ابزارها برای نیازهای مختلف در دسترس است. پیشرفتهای اخیر در الگوریتمهای پردازش تصویر، هوش مصنوعی و یادگیری ماشین، به بهبود چشمگیر دقت و قابلیتهای این نرم افزارها منجر شده است.
در حوزه بالینی، این نرم افزارها نقش مهمی در استانداردسازی تفسیر نتایج، کاهش خطاهای انسانی و بهبود تصمیمگیریهای تشخیصی ایفا میکنند. در زمینه تحقیقاتی نیز، امکان آنالیز حجم بالایی از دادهها، کشف الگوها و شناسایی بیومارکرهای جدید را فراهم میکنند. یکپارچهسازی با سایر تکنولوژیهای omics و پلتفرمهای بیوانفورماتیک، افقهای جدیدی در درک سیستمهای بیولوژیک گشوده است.
آینده این نرم افزارها با پیشرفت در هوش مصنوعی، محاسبات ابری، اتوماسیون پیشرفته و یکپارچهسازی بیشتر شکل خواهد گرفت. این پیشرفتها به نوبه خود به توسعه روشهای دقیقتر و سریعتر برای تشخیص بیماریها، کشف داروهای جدید و درک عمیقتر از فرآیندهای بیولوژیک منجر خواهد شد.
با توجه به اهمیت روزافزون آنالیز پروتئین در تحقیقات پزشکی و زیستی، آشنایی با این نرم افزارها و قابلیتهای آنها برای محققان، متخصصان آزمایشگاهی و دانشجویان این حوزهها ضروری است. انتخاب نرم افزار مناسب بر اساس نیازهای خاص هر آزمایشگاه، آموزش کافی کاربران و بهروز ماندن با پیشرفتهای جدید، کلید بهرهبرداری موثر از این ابزارهای قدرتمند است.
الکتروفورز پروتئین یک تکنیک آزمایشگاهی است که برای جداسازی پروتئینها بر اساس وزن مولکولی، بار الکتریکی یا ساختار فضایی آنها استفاده میشود. این تکنیک در تحقیقات زیستی، پروتئومیکس، و تشخیص بالینی کاربردهای فراوانی دارد.
رایجترین روشها شامل SDS-PAGE، الکتروفورز نیتیو، ایزوالکتریک فوکوسینگ (IEF)، و الکتروفورز دو بعدی هستند. هر روش برای اهداف خاصی بهینه شده؛ برای مثال، SDS-PAGE برای جداسازی بر اساس وزن مولکولی و IEF برای جداسازی بر اساس نقطه ایزوالکتریک استفاده میشود.
این نرم افزارها با پردازش تصاویر ژل، شناسایی باندهای پروتئینی، کمیسازی آنها، و محاسبه وزن مولکولی، به افزایش دقت و سرعت آنالیز نتایج کمک میکنند. همچنین، برخی از نرم افزارها قابلیت مقایسه بین ژلها و ارائه گزارشهای آماری را دارند.
بله، نرم افزارهای رایگان مانند ImageJ و GelAnalyzer ابزارهای قدرتمندی برای آنالیز تصاویر ژل ارائه میدهند. با این حال، ممکن است برخی قابلیتهای پیشرفته موجود در نرم افزارهای تجاری را نداشته باشند، اما برای بسیاری از کاربردهای معمول آزمایشگاهی کافی هستند.

تیم تولید محتوای گروه بیوانفورماتیک وانیار در تلاش است تا بهترین آموزشهای کوتاه در زمینه بیوانفورماتیک و زیستشناسی را تهیه نماید. صحت محتوای این صفحه توسط کارشناسان گروه بیوانفورماتیک وانیار بررسی شده است.
عضویت در مجله وانیار
جدید ترین مقالات در ایمیل شما!
با عضویت در مجله بیوانفورماتیک وانیار ، برترین مقالات را در ایمیل خود دریافت کنید.
سلام، وقت بخیر.
چطور میتونیم بهتون کمک کنیم؟ 🤓
تیم ما آماده پاسخگویی به سوالات شماست.
پشتیبانی 24 ساعته در 7 روز هفته.