دوره NGS منتشر شد …

پروتئینها به عنوان ماکرومولکولهای اصلی حیات، نقشی محوری در تمامی فرآیندهای بیولوژیک ایفا میکنند. این مولکولهای حیاتی از آنزیمها و هورمونها گرفته تا اجزای ساختاری و پروتئینهای انتقالدهنده، شالوده عملکردهای سلولی را تشکیل میدهند. آنچه پروتئینها را منحصربهفرد میسازد، ارتباط مستقیم بین ساختار سهبعدی و عملکرد آنهاست. به عبارت دیگر، نحوه تاخوردگی زنجیرههای پپتیدی در فضای سهبعدی تعیینکننده خصوصیات عملکردی و بیولوژیک هر پروتئین است. در عصر حاضر، پژوهشگران با درک عمیق از ساختار پروتئینها، به پیشرفتهای چشمگیری در زمینههای مختلفی مانند طراحی دارو، طراحی واکسن، بیوتکنولوژی، پزشکی مولکولی و مهندسی پروتئین دست یافتهاند.
در این مقاله، به بررسی جامع سطوح مختلف ساختاری پروتئینها، روشهای تعیین و پیشبینی ساختار، و کاربردهای بیوانفورماتیک در مطالعه پروتئینها خواهیم پرداخت. هدف ما ارائه دیدگاهی کامل از مفاهیم پایه تا پیشرفتهترین تکنیکهای محاسباتی در حوزه ساختار پروتئین است که برای دانشجویان، محققان و علاقهمندان به علوم زیستی مفید واقع شود.
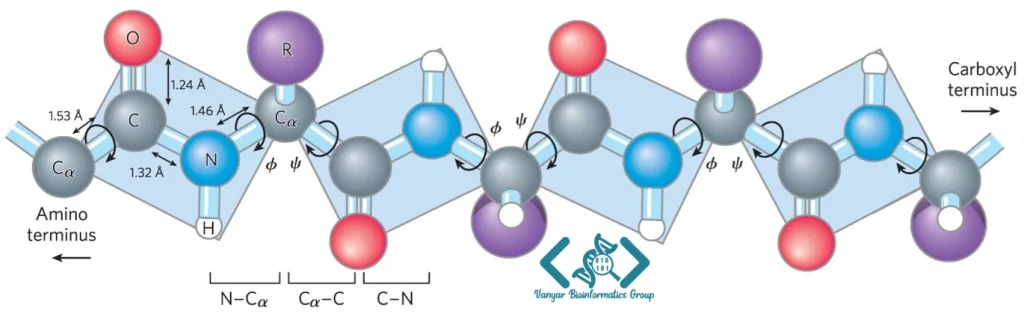
پروتئینها از واحدهای ساختاری کوچکتری به نام آمینواسید تشکیل شدهاند. در طبیعت، ۲۰ نوع آمینواسید استاندارد وجود دارد که همگی دارای یک گروه آمین و یک گروه کربوکسیل متصل به کربن مرکزی (کربن آلفا) هستند. تفاوت اصلی میان این آمینواسیدها در زنجیره جانبی آنهاست که خصوصیات فیزیکوشیمیایی متنوعی از جمله آبدوستی، آبگریزی، قطبی بودن و بار الکتریکی را به آنها میبخشد. آمینواسیدها از طریق پیوندهای پپتیدی (که از اتصال گروه کربوکسیل یک آمینواسید به گروه آمین آمینواسید دیگر تشکیل میشود) به یکدیگر متصل میشوند و زنجیرههای پلیپپتیدی را تشکیل میدهند.
توالی خطی آمینواسیدها، که سلول آن را بر اساس اطلاعات ژنتیکیِ RNA ترجمه میکند، ساختار نهایی پروتئین را تعیین میکند. این اصل بنیادی که توسط کریستین آنفینسن (Christian Anfinsen) در دهه ۱۹۵۰ مطرح شد، بیان میکند که تمام اطلاعات لازم برای تاخوردگی صحیح یک پروتئین در توالی اسیدهای آمینه آن قرار دارد. عوامل محیطی مانند pH، دما، غلظت نمک و حضور مولکولهای دیگر نیز بر فرآیند تاخوردگی تأثیرگذارند، اما در نهایت، این توالی آمینواسیدها است که مسیر تاخوردگی و ساختار نهایی را مشخص میکند.
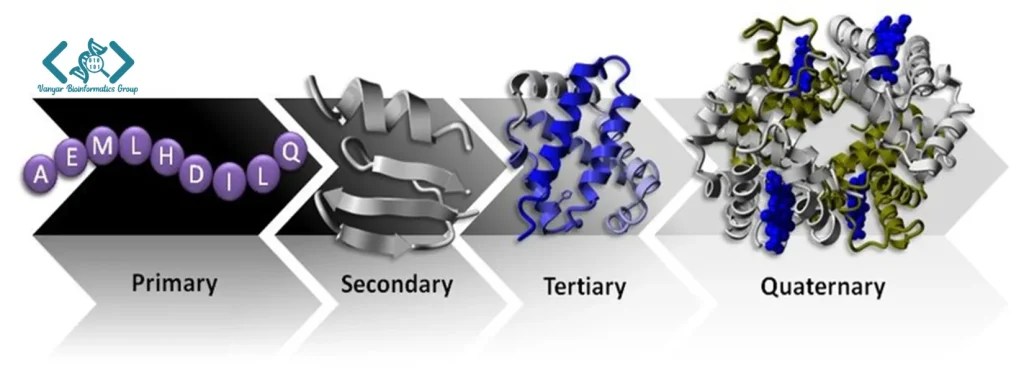
ساختار اولیه پروتئین، سادهترین سطح ساختاری است که به توالی خطی آمینواسیدها در زنجیره پلیپپتیدی اشاره دارد. این توالی از انتهای آمینی (N-terminal) شروع و به انتهای کربوکسیلی (C-terminal) ختم میشود. ساختار اولیه همانند نقشه ژنتیکی پروتئین عمل میکند و تمام اطلاعات لازم برای تاخوردگی صحیح را در خود دارد. با وجود سادگی ظاهری، ساختار اولیه نقشی حیاتی در تعیین خصوصیات و عملکرد نهایی پروتئین ایفا میکند. تغییرات جزئی در توالی آمینواسیدها، مانند جهش نقطهای که منجر به جایگزینی یک آمینواسید با آمینواسید دیگر میشود، میتواند تأثیرات عمیقی بر ساختار و عملکرد پروتئین داشته باشد.
امروزه، تعیین توالی پروتئینها با استفاده از روشهای پیشرفته همچون طیفسنجی جرمی و توالییابی مستقیم انجام میشود. در عصر ژنومیک، توالی پروتئینها اغلب به طور غیرمستقیم و از طریق توالییابی DNA و ترجمه کدونها به آمینواسیدها مشخص میشود. پایگاههای دادهای مانند UniProt و NCBI Protein، میلیونها توالی پروتئینی را از گونههای مختلف جمعآوری کردهاند که منبعی ارزشمند برای مطالعات بیوانفورماتیک و تحلیلهای مقایسهای محسوب میشوند.
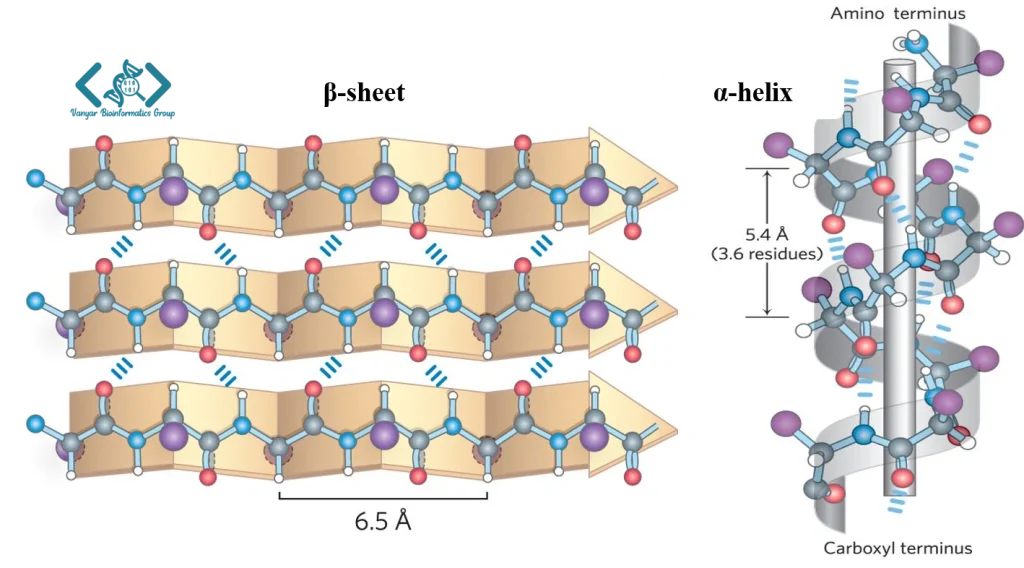
ساختار ثانویه پروتئین به الگوهای تاخوردگی محلی و منظم در زنجیره پلیپپتیدی اشاره دارد که عمدتاً توسط پیوندهای هیدروژنی بین اتمهای اسکلت پپتیدی (نه زنجیرههای جانبی) پایدار میشوند. دو نوع اصلی ساختار ثانویه، مارپیچ آلفا (α-helix) و صفحات بتا (β-sheet) هستند که توسط لینوس پاولینگ و رابرت کوری در دهه ۱۹۵۰ شناسایی و توصیف شدند. در مارپیچ آلفا، زنجیره پلیپپتیدی به شکل مارپیچی راستگرد تاخورده و با پیوندهای هیدروژنی بین گروه کربونیل یک آمینواسید و گروه آمین آمینواسید چهارم بعد از آن (4+i) پایدار میشود. هر دور کامل مارپیچ آلفا شامل ۳.۶ آمینواسید است.
ساختارهای زیکزاکی اسکلت پپتیدی، با قرار گرفتن در کنار یکدیگر، صفحات بتا را تشکیل میدهند و پیوندهای هیدروژنی این ساختارها را به هم متصل میکنند. این ساختارها میتوانند به صورت موازی (همه رشتهها در یک جهت) یا غیرموازی (رشتهها در جهات مخالف) آرایش یابند. علاوه بر این دو ساختار اصلی، ساختارهای ثانویه دیگری نیز وجود دارند، از جمله پیچها (turns) و حلقهها (loops) که اغلب نقش اتصالدهنده بین ساختارهای منظمتر را ایفا میکنند. روشهای متداول برای تعیین ساختار ثانویه شامل طیفسنجی دورنگی نمایی دایرهای (CD)، طیفسنجی مادون قرمز فوریه (FTIR) و تحلیلهای محاسباتی مانند DSSP برای ساختارهای سهبعدی شناختهشده است.
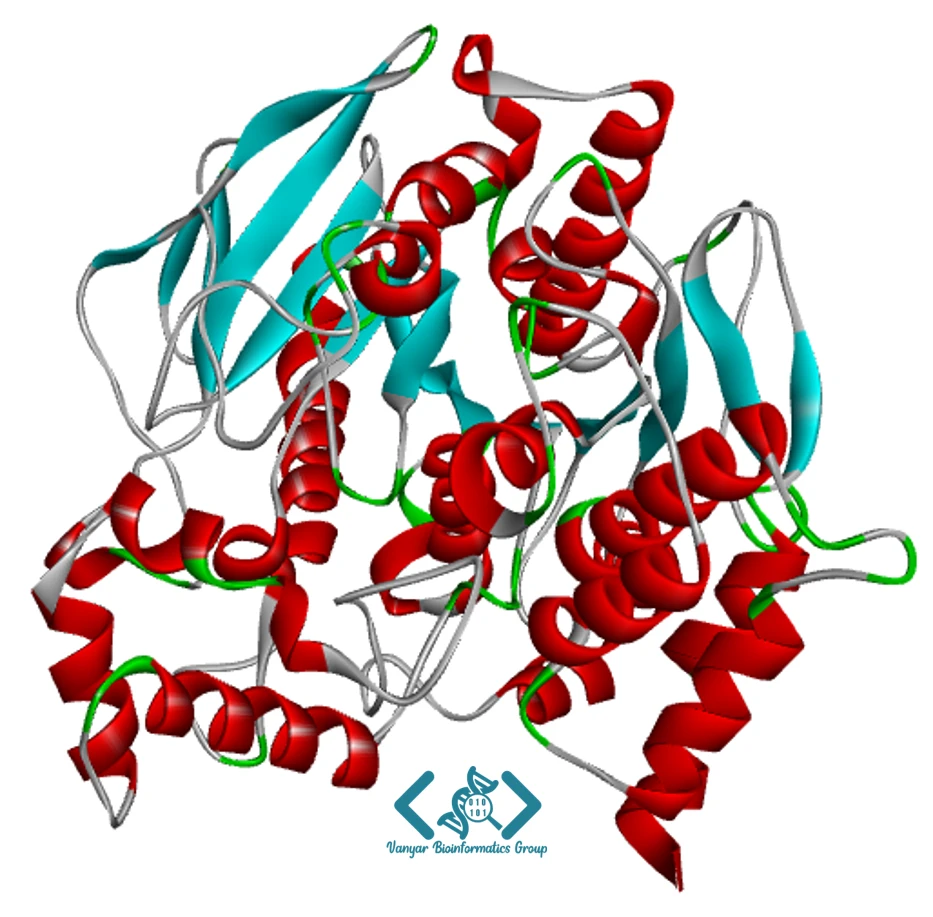
ساختار سوم پروتئین به آرایش سهبعدی کامل زنجیره پلیپپتیدی اشاره دارد و نشاندهنده تاخوردگی فضایی تمام اتمهای زنجیره اصلی و زنجیرههای جانبی است. این سطح ساختاری، پیچیدهترین و کاملترین نمایش از یک پروتئین تکزنجیرهای است. ساختار سوم از طریق برهمکنشهای متنوعی پایدار میشود که مهمترین آنها عبارتند از: برهمکنشهای آبگریز بین زنجیرههای جانبی غیرقطبی، پیوندهای هیدروژنی، برهمکنشهای یونی (نمکی)، پیوندهای دیسولفیدی و نیروهای واندروالس. در میان این نیروها، برهمکنشهای آبگریز نقش اساسی در شکلگیری اولیه ساختار سوم دارند.
ساختار سوم معمولاً به دومینهای ساختاری (structural domains) تقسیم میشود که هر دومین واحد مستقل و فشردهای از تاخوردگی پروتئین است. دومینها اغلب واحدهای عملکردی مستقلی هستند و میتوانند وظایف خاصی مانند اتصال به لیگاند، فعالیت کاتالیتیکی یا برهمکنش با سایر پروتئینها را انجام دهند. پروتئینهای بزرگ معمولاً از چندین دومین تشکیل شدهاند که با مناطق انعطافپذیری به یکدیگر متصل میشوند. تعیین ساختار سوم نیازمند تکنیکهای پیشرفتهای مانند کریستالوگرافی اشعه ایکس، طیفسنجی رزونانس مغناطیسی هسته (NMR) یا میکروسکوپ الکترونی کرایو (Cryo-EM) است. امروزه، پیشرفتهای چشمگیر در زمینه بیوانفورماتیک، بهویژه با معرفی AlphaFold توسط DeepMind، امکان تعیین دقیق ساختار سوم پروتئینها را تنها با استفاده از توالی آنها فراهم کرده است.
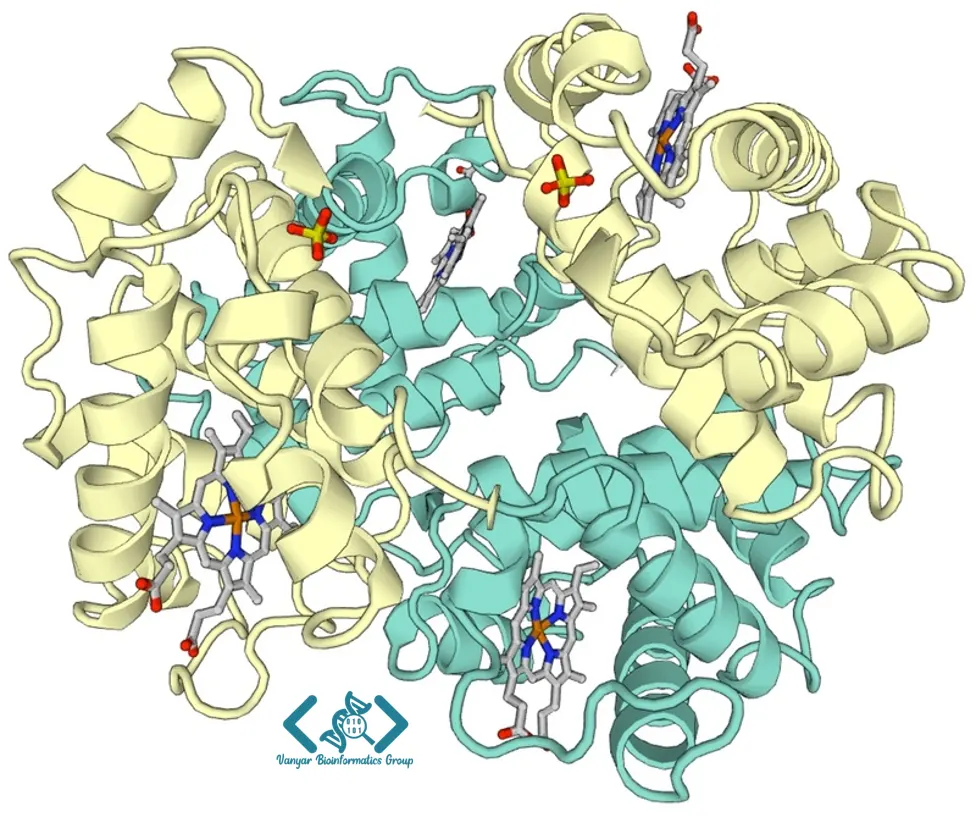
ساختار چهارم به آرایش فضایی و نحوه تجمع چندین زنجیره پلیپپتیدی (زیرواحد) در یک پروتئین چندزیرواحدی اشاره دارد. هر زیرواحد میتواند مشابه سایر زیرواحدها (هموالیگومر) یا متفاوت از آنها (هتروالیگومر) باشد. برهمکنشهای بین زیرواحدی که ساختار چهارم را پایدار میکنند، مشابه نیروهای پایدارکننده ساختار سوم هستند، با این تفاوت که این برهمکنشها بین زنجیرههای مجزا رخ میدهند. هموگلوبین مثال کلاسیک یک پروتئین با ساختار چهارم است. چهار زیرواحد (دو زنجیره آلفا و دو زنجیره بتا) این پروتئین را تشکیل میدهند و با همکاری یکدیگر، انتقال اکسیژن در خون را امکانپذیر میسازند.
ساختار چهارم نقش مهمی در تنظیم عملکرد پروتئینها دارد. بسیاری از آنزیمهای چندزیرواحدی مکانیسمهای تنظیمی آلوستریک را نشان میدهند، جایی که اتصال یک مولکول به یک زیرواحد میتواند تغییرات ساختاری را به سایر زیرواحدها منتقل کند و فعالیت کل مجموعه را تحت تأثیر قرار دهد. کمپلکسهای پروتئینی بزرگ مانند ریبوزومها، پروتئازومها و کانالهای یونی، نمونههای پیچیدهای از ساختار چهارم هستند که از دهها زیرواحد مختلف تشکیل شدهاند. مطالعه این کمپلکسهای پیچیده اغلب نیازمند رویکردهای ترکیبی شامل میکروسکوپ الکترونی کرایو، کریستالوگرافی اشعه ایکس و روشهای بیوفیزیکی مکمل است.
کریستالوگرافی اشعه ایکس (X-ray Crystallography) قدیمیترین و پرکاربردترین روش برای تعیین ساختار سهبعدی پروتئینها است. در این روش، ابتدا پروتئین خالصسازی شده و تحت شرایط خاصی کریستاله میشود. سپس این کریستالها در معرض اشعه ایکس قرار میگیرند و الگوی پراش حاصل ثبت میشود. با تحلیل این الگوها و بازسازی تابع چگالی الکترونی، موقعیت دقیق اتمها در ساختار پروتئین مشخص میشود. این تکنیک قادر است ساختارهایی با وضوح اتمی (تا حد ۱ آنگستروم) ارائه دهد که جزئیات دقیقی از پیوندها، زوایا و تعاملات مولکولی را نشان میدهد.
با وجود مزایای فراوان، کریستالوگرافی اشعه ایکس با چالشهایی نیز همراه است. مهمترین محدودیت این روش، نیاز به کریستالهای با کیفیت بالاست. بسیاری از پروتئینها، بهویژه پروتئینهای غشایی، پروتئینهای بینظم ذاتی و کمپلکسهای بزرگ، به سختی کریستاله میشوند. علاوه بر این، ساختار پروتئین در کریستال ممکن است به دلیل تماسهای کریستالی و شرایط غیرفیزیولوژیک، با حالت طبیعی آن در محلول تفاوتهایی داشته باشد. باوجود این محدودیتها، بیش از ۸۵٪ از ساختارهای موجود در بانک دیتای پروتئین (PDB) با استفاده از این روش تعیین شدهاند.
طیفسنجی رزونانس مغناطیسی هسته (NMR) روشی قدرتمند برای تعیین ساختار پروتئینها در محلول است که اطلاعات ارزشمندی درباره دینامیک مولکولی نیز فراهم میکند. در این روش، نمونه پروتئینی در یک میدان مغناطیسی قوی قرار میگیرد و با امواج رادیویی تحریک میشود. اتمهای دارای اسپین هستهای (مانند ¹H، ¹³C و ¹⁵N) سیگنالهایی تولید میکنند که وابسته به محیط شیمیایی آنهاست. با تحلیل این سیگنالها و اندازهگیری برهمکنشهای بین هستهای (مانند جفتشدگی اسکالر و اثر نوکلئار اورهاوزر)، میتوان محدودیتهای فاصلهای و زاویهای را استخراج کرد و از آنها برای محاسبه ساختار سهبعدی استفاده نمود.
مزیت اصلی NMR توانایی آن در مطالعه پروتئینها در شرایط نزدیک به محیط فیزیولوژیک و بررسی تغییرات کنفورماسیونی و دینامیک آنها در مقیاس زمانی مختلف است. همچنین، این روش برای پروتئینهایی که کریستاله نمیشوند یا دارای نواحی بینظم هستند، بسیار مفید است. با این حال، NMR نیز محدودیتهایی دارد: این روش عمدتاً برای پروتئینهای کوچک تا متوسط (کمتر از ۳۰ کیلودالتون) مناسب است و وضوح ساختاری آن معمولاً پایینتر از کریستالوگرافی اشعه ایکس است. پیشرفتهای اخیر در زمینه طراحی آزمایشهای NMR، مگنتهای قویتر و روشهای نشاندارکردن ایزوتوپی، محدوده کاربرد این تکنیک را گسترش داده است.
میکروسکوپ الکترونی کرایو (Cryo-EM) در سالهای اخیر به انقلابی در علم ساختار پروتئین تبدیل شده است. این روش امکان مطالعه کمپلکسهای پروتئینی بزرگ و پروتئینهای غشایی را که با روشهای سنتی دشوار بودند، فراهم کرده است. در Cryo-EM، نمونه پروتئینی در یک لایه نازک از یخ آمورف منجمد میشود و سپس با استفاده از باریکه الکترونی مورد تصویربرداری قرار میگیرد. هزاران یا میلیونها تصویر دوبعدی از مولکولها در جهتگیریهای مختلف جمعآوری شده و با الگوریتمهای پیشرفته پردازش تصویر و بازسازی سهبعدی، به یک نقشه تراکم سهبعدی تبدیل میشوند. سپس مدل اتمی پروتئین در این نقشه تراکم جایگذاری میشود.
پیشرفتهای اخیر در تکنولوژی آشکارسازهای الکترونی با پایه CMOS، منابع الکترونی پایدارتر و الگوریتمهای پیشرفته پردازش تصویر منجر به “انقلاب وضوح” در Cryo-EM شده است. امروزه این روش قادر است ساختارهایی با وضوح نزدیک به اتمی (حدود ۲-۳ آنگستروم) ارائه دهد. از مزایای مهم Cryo-EM میتوان به نیاز به مقدار کم نمونه، عدم ضرورت کریستالهسازی و توانایی تفکیک حالتهای کنفورماسیونی مختلف در یک نمونه اشاره کرد. این تکنیک بهویژه برای مطالعه ماکرومولکولهای بیولوژیک بزرگ مانند ریبوزومها، کانالهای یونی و کمپلکسهای چندپروتئینی ارزشمند است. اهمیت Cryo-EM با اعطای جایزه نوبل شیمی سال ۲۰۱۷ به پیشگامان این فناوری (جاکس دوبوشه، یواخیم فرانک و ریچارد هندرسون) به رسمیت شناخته شد.
پیشبینی ساختار پروتئین از توالی اسید آمینه آن، یکی از چالشهای اصلی در بیوانفورماتیک ساختاری بوده است. روشهای سنتی پیشبینی ساختار را میتوان به سه دسته اصلی تقسیم کرد: روشهای مبتنی بر الگو (مدلسازی همولوژی و threading)، روشهای ab initio و روشهای ترکیبی.
انقلاب واقعی در پیشبینی ساختار پروتئین با معرفی AlphaFold توسط DeepMind در سال ۲۰۱۸ و نسخه بهبودیافته آن (AlphaFold2) در سال ۲۰۲۰ رخ داد. AlphaFold2 از شبکههای عصبی عمیق برای یادگیری الگوهای تکاملی و فیزیکی پیچیده استفاده میکند و میتواند ساختار پروتئینها را با دقتی نزدیک به روشهای تجربی پیشبینی کند. موفقیت چشمگیر AlphaFold در مسابقه CASP14 (ارزیابی جامع پیشبینی ساختار پروتئین) با کسب میانگین نمره GDT_TS بالای ۹۲٪، به عنوان نقطه عطفی در حل مسئله تاخوردگی پروتئین شناخته میشود. در آموزش AlphaFold، به روش استفاده از این ابزار پرداختهایم.
شبیهسازی دینامیک مولکولی (MD) ابزاری قدرتمند برای مطالعه رفتار دینامیکی پروتئینها در مقیاس اتمی است. در این روش، حرکت اتمها و مولکولها با استفاده از معادلات فیزیک کلاسیک (قوانین نیوتن) و میدانهای نیرو تجربی شبیهسازی میشود. شبیهسازی MD اطلاعات ارزشمندی درباره تغییرات کنفورماسیونی، مسیرهای تاخوردگی، مکانیسمهای کاتالیتیکی، برهمکنش پروتئین-لیگاند و پایداری حرارتی پروتئینها ارائه میدهد. پیشرفتهای اخیر در سختافزارهای محاسباتی و الگوریتمهای شبیهسازی، امکان بررسی سیستمهای بزرگتر در مقیاس زمانی طولانیتر (میکروثانیه تا میلیثانیه) را فراهم کرده است.
نرمافزارهای محبوب برای شبیهسازی MD شامل GROMACS، AMBER، NAMD و CHARMM هستند. این نرمافزارها از میدانهای نیروی مختلفی پشتیبانی میکنند که پارامترهای لازم برای توصیف برهمکنشهای اتمی را فراهم میسازند. روشهای نوین شبیهسازی مانند شبیهسازی مارکوف تبادلی (Replica Exchange MD) و شبیهسازی سوگیری (Biased MD) برای غلبه بر محدودیتهای شبیهسازیهای استاندارد و نمونهبرداری کارآمدتر از فضای کنفورماسیونی توسعه یافتهاند. ترکیب شبیهسازیهای MD با دادههای تجربی حاصل از NMR یا SAXS (پراکندگی اشعه ایکس با زاویه کوچک) منجر به درک عمیقتری از ارتباط ساختار-دینامیک-عملکرد پروتئینها میشود.
گسترش روزافزون دادههای ساختاری پروتئینها نیازمند ابزارها و دیتابیسهای تخصصی برای ذخیرهسازی، دستهبندی و تحلیل این اطلاعات است. بانک دیتای پروتئین (Protein Data Bank یا PDB) مهمترین مخزن جهانی ساختارهای سهبعدی ماکرومولکولهای بیولوژیک است که دارای بیش از ۱۸۷,۰۰۰ ساختار پروتئینی، اسید نوکلئیک و کمپلکسهای آنها میباشد. دیتابیسهای تخصصیتر مانند SCOP (طبقهبندی ساختاری پروتئینها) و CATH به طبقهبندی پروتئینها بر اساس ساختار تاخوردگی و روابط تکاملی آنها میپردازند. پایگاههای دیگری مانند PROSITE، PFAM و InterPro الگوهای توالی و دومینهای ساختاری-عملکردی را شناسایی میکنند.
برای تحلیل ساختارهای پروتئینی، نرمافزارهای متعددی توسعه یافتهاند. نرمافزارهای مصورسازی مانند PyMOL، Chimera و VMD امکان نمایش تعاملی و تحلیل بصری ساختارهای سهبعدی را فراهم میکنند. ابزارهای محاسباتی مانند DSSP برای تشخیص ساختارهای ثانویه، PISA برای تحلیل سطوح تماس پروتئین-پروتئین و CASTp برای شناسایی حفرهها و جایگاههای اتصال لیگاند استفاده میشوند. وبسرورهایی مانند ConSurf تحلیل حفاظتشدگی تکاملی را با نگاشت دادههای توالی بر روی ساختار سهبعدی انجام میدهند. ترکیب این ابزارها با دادههای عملکردی و ژنومیکی، دیدگاه جامعی از ارتباط بین ساختار، تکامل و عملکرد پروتئینها ارائه میدهد.
درک ساختار سهبعدی پروتئینها نقشی حیاتی در طراحی منطقی دارو (Structure-Based Drug Design) ایفا میکند. این رویکرد بر اساس شناخت دقیق ساختار مولکولی پروتئینهای هدف و طراحی ترکیباتی که به صورت اختصاصی با آنها برهمکنش میکنند، استوار است. فرآیند طراحی دارو مبتنی بر ساختار معمولاً با مشخص کردن جایگاه اتصال هدف دارویی (مانند جایگاه فعال آنزیم یا جایگاه اتصال رسپتور) آغاز میشود. سپس با استفاده از روشهای داکینگ مولکولی، کتابخانههای مجازی ترکیبات شیمیایی برای یافتن مولکولهایی که بهخوبی در این جایگاه جای میگیرند، غربالگری میشوند. کاندیداهای برتر سپس در آزمایشگاه سنتز شده و مورد آزمایش قرار میگیرند.
پیشرفتهای اخیر در هوش مصنوعی و یادگیری ماشین، رویکردهای طراحی دارو را متحول کرده است. الگوریتمهای پیشرفته قادرند الگوهای پیچیده در دادههای برهمکنش پروتئین-لیگاند را شناسایی کنند و مولکولهایی با خصوصیات دارویی مطلوب را طراحی نمایند. استفاده از روشهای دینامیک مولکولی و محاسبات انرژی آزاد برای ارزیابی دقیقتر برهمکنشهای پروتئین-لیگاند نیز رو به گسترش است. موفقیتهای چشمگیر این رویکرد در توسعه داروهای مختلف مانند مهارکنندههای HIV پروتئاز، مهارکنندههای تیروزین کیناز برای درمان سرطان و داروهای ضدویروسی مانند مهارکنندههای نورآمینیداز برای آنفولانزا مشاهده شده است. فناوریهای نوین مانند کریوژنیک EM امکان طراحی دارو برای اهداف پیچیدهتر مانند کانالهای یونی و GPCRها را نیز فراهم کرده است.
مطالعات ساختاری پروتئینها نقش کلیدی در درک مولکولی بیماریها و توسعه درمانهای نوین ایفا میکنند. بسیاری از بیماریهای ژنتیکی و اکتسابی نتیجه نقص در ساختار و عملکرد پروتئینها هستند. جهشهای نقطهای، حذفها، اضافات و تغییرات پسازترجمهای نادرست میتوانند منجر به تاخوردگی نامناسب، تجمع و یا عملکرد نابهنجار پروتئینها شوند. برای مثال، جهش در پروتئین CFTR منجر به بیماری فیبروز کیستیک، جهش در هموگلوبین باعث کمخونی داسیشکل و تجمع پروتئینهای بتا-آمیلوئید و تاو با بیماری آلزایمر مرتبط است. مطالعات ساختاری این پروتئینهای جهشیافته به درک مکانیسمهای مولکولی بیماریزایی و طراحی استراتژیهای درمانی کمک شایانی میکند.
روشهای نوین درمانی مبتنی بر دانش ساختاری شامل استفاده از مولکولهای کوچک تثبیتکننده پروتئین (مانند داروهای چاپرونی برای بیماری گوشه (Gaucher’s disease))، مهارکنندههای اختصاصی برای پروتئینهای بیشفعال (مانند مهارکنندههای کیناز در سرطان)، آنتیبادیهای درمانی مهندسیشده و روشهای ژندرمانی برای جایگزینی پروتئینهای معیوب است. پیشرفتهای اخیر در ادیت ژنوم با فناوری CRISPR-Cas9 و روشهای تحویل هدفمند نیز چشمانداز امیدبخشی برای درمان بیماریهای ژنتیکی ایجاد کرده است. پژوهشگران با مطالعه ساختار پروتئینهای CRISPR-Cas9، سیستمهای ادیت ژنومی دقیقتر و کارآمدتری طراحی کردهاند.
مهندسی پروتئین فرآیند طراحی و تولید پروتئینهایی با خصوصیات جدید یا بهبودیافته است که بر دانش عمیق از ارتباط بین توالی، ساختار و عملکرد پروتئینها متکی است. این حوزه از جنبههای مختلف در بیوتکنولوژی، پزشکی و صنایع شیمیایی کاربرد دارد. روشهای مهندسی پروتئین به دو دسته کلی تقسیم میشوند: روشهای منطقی (Rational Design) که بر اساس دانش ساختاری و محاسبات مولکولی استوارند، و روشهای تکاملی (Directed Evolution) که بر تنوع ژنتیکی تصادفی و غربالگری یا انتخاب برای عملکرد مطلوب تکیه دارند.
کاربردهای مهندسی پروتئین بسیار متنوع است. در صنعت، آنزیمهای مهندسیشده با پایداری بالاتر در برابر دما، pH و حلالهای آلی برای فرآیندهای صنعتی مانند تولید شویندهها، فرآوری غذا و تولید بیوفیول یا زیستسوخت استفاده میشوند. در حوزه پزشکی، پروتئینهای درمانی مانند انسولین، اینترفرونها و فاکتورهای انعقادی با خصوصیات فارماکوکینتیکی بهبودیافته طراحی شدهاند. آنتیبادیهای مونوکلونال مهندسیشده و پروتئینهای دوعاملی (bispecific) برای ایمونوتراپی سرطان استفاده میشوند. در زیستحسگرها، پروتئینهای فلورسنت مهندسیشده مانند GFP با خصوصیات طیفی متنوع برای تصویربرداری سلولی به کار میروند. پیشرفتهای اخیر در هوش مصنوعی و روشهای محاسباتی، امکان طراحی پروتئینهایی با تاخوردگیهای جدید و عملکردهای بیسابقه را فراهم کرده که مرزهای مهندسی پروتئین را گسترش داده است.
علیرغم پیشرفتهای چشمگیر در فناوریهای تعیین ساختار پروتئین، چالشهای مهمی همچنان وجود دارد. برای کریستالوگرافی اشعه ایکس، تولید کریستالهای با کیفیت هنوز یک مرحله محدودکننده است، بهویژه برای پروتئینهای غشایی، پروتئینهای بینظم ذاتی و کمپلکسهای بزرگ. در مورد NMR، محدودیت اندازه پروتئین و پیچیدگی دادهها برای مولکولهای بزرگتر چالشبرانگیز است. Cryo-EM نیز با محدودیتهایی در وضوح (به ویژه برای پروتئینهای کوچکتر از ۵۰ کیلودالتون) و نیاز به تجهیزات گرانقیمت مواجه است. علاوه بر این، برخی از پروتئینها به دلیل انعطافپذیری بالا، ناپایداری یا تمایل به تجمع، با هیچ یک از روشهای موجود به راحتی قابل مطالعه نیستند.
رویکردهای نوینی برای غلبه بر این محدودیتها در حال توسعه هستند. روشهای هیبریدی که ترکیبی از چندین تکنیک تجربی (مانند NMR، SAXS، Cryo-EM و طیفسنجی دومرنگی حلقوی) و روشهای محاسباتی را به کار میگیرند، اطلاعات جامعتری درباره ساختار و پویایی پروتئینها ارائه میدهند. تکنیکهای نوآورانه کریستالوگرافی مانند میکروکریستالوگرافی سریال با لیزر اشعه ایکس آزاد الکترون (XFEL)، امکان مطالعه کریستالهای میکرومتری و بررسی دینامیک مولکولی در مقیاس زمانی فمتوثانیه را فراهم میکند. پیشرفتهای مداوم در طراحی آشکارسازها و الگوریتمهای پردازش تصویر برای Cryo-EM محدوده کاربرد این روش را به پروتئینهای کوچکتر گسترش میدهد. در عرصه بیوانفورماتیک، روشهای هوش مصنوعی و یادگیری عمیق برای بهبود کیفیت دادههای تجربی و پیشبینی ساختارهایی که با روشهای تجربی دشوار هستند، امیدبخش است.
بخش قابل توجهی از پروتئوم سلولی را پروتئینهای “نامرئی” تشکیل میدهند که با روشهای متداول ساختارشناسی به سختی قابل مطالعه هستند. دو گروه مهم از این پروتئینها، پروتئینهای بینظم ذاتی (IDPs) و پروتئینهای غشایی هستند. پروتئینهای بینظم ذاتی فاقد ساختار سهبعدی مشخص و پایدار هستند و از نظر کنفورماسیونی بسیار انعطافپذیرند. این پروتئینها نقش مهمی در تنظیم بیان ژن، سیگنالینگ سلولی، شناخت مولکولی و تشکیل اجتماعات بیومولکولی بدون غشا (Biomolecular Condensates) ایفا میکنند. به دلیل پویایی بالا، IDPها با روشهای سنتی کریستالوگرافی قابل مطالعه نیستند و نیازمند ترکیبی از تکنیکهای NMR، SAXS، طیفسنجی تکمولکولی و شبیهسازیهای مولکولی هستند.
پروتئینهای غشایی که حدود ۳۰٪ از پروتئوم را تشکیل میدهند و هدف بیش از ۶۰٪ داروهای موجود هستند، چالش دیگری در مطالعات ساختاری محسوب میشوند. این پروتئینها به دلیل ماهیت آمفیپاتیک، ناپایداری خارج از محیط غشایی و پیچیدگیهای مرتبط با خالصسازی و کریستاله کردن، دشوار هستند. پیشرفتهای اخیر در تکنیکهای پایدارسازی (مانند نانودیسکها و آپوفرمین)، روشهای بیان بهینهشده و بهویژه Cryo-EM افقهای جدیدی در مطالعه ساختاری پروتئینهای غشایی گشوده است. درک بهتر این “پروتئومهای نامرئی” برای تکمیل تصویر جامع از عملکرد سلولی و توسعه درمانهای هدفمندتر ضروری است و یکی از مرزهای هیجانانگیز تحقیقات ساختاری محسوب میشود.
آینده مطالعات ساختاری پروتئین با پیشرفتهای شگفتانگیز در هوش مصنوعی، بیولوژی مصنوعی و پزشکی شخصیسازیشده گره خورده است. در حوزه هوش مصنوعی، موفقیت AlphaFold2 تنها آغاز راه است. نسل بعدی الگوریتمهای یادگیری عمیق میتواند پیشبینی کمپلکسهای پروتئینی، پروتئینهای بینظم، برهمکنشهای پروتئین-لیگاند و حتی طراحی پروتئینهای جدید را با دقت بیشتری انجام دهد. ترکیب مدلهای زبانی بزرگ (LLMs) با مدلهای ساختاری، امکان ترجمه زبان طبیعی به طراحی پروتئین و بالعکس را فراهم میکند. نتیجه این پیشرفتها، دموکراتیزه شدن طراحی پروتئین و دسترسی گستردهتر به این فناوری خواهد بود.
در زمینه بیولوژی مصنوعی، طراحی پروتئینهای غیرطبیعی با عملکردهای جدید یا بهبودیافته به واقعیت تبدیل شده است. دانشمندان موفق به طراحی آنزیمهای کاتالیزور واکنشهایی شدهاند که در طبیعت وجود ندارند، مدارهای منطقی پروتئینی برای محاسبات سلولی ساختهاند و ساختارهای خودآرا با کاربردهای متنوع در نانوتکنولوژی و پزشکی ایجاد کردهاند. آینده این حوزه میتواند شامل طراحی سلولهای مصنوعی با مجموعهای کاملاً جدید از پروتئینها برای کاربردهای تشخیصی، درمانی و صنعتی باشد.
در پزشکی شخصیسازیشده، توالییابی سریع و ارزان ژنوم بیماران به همراه پیشبینی ساختار پروتئینهای جهشیافته، امکان درک دقیق مکانیسمهای مولکولی بیماریها و طراحی درمانهای اختصاصی را فراهم میکند. دیجیتالسازی زیستشناسی و توسعه نسخههای مجازی (Digital Twins) از سیستمهای بیولوژیک، به پیشبینی پاسخ فرد به درمانهای مختلف کمک میکند. به طور خلاصه، آینده مطالعات ساختاری پروتئین با ادغام علوم داده، فناوریهای پیشرفته محاسباتی و تجربی، و رویکردهای چندرشتهای شکل میگیرد که افقهای جدیدی در درک و دستکاری سیستمهای زیستی میگشاید.
ساختار سهبعدی پروتئینها، ستون فقرات درک ما از فرآیندهای بیولوژیک است. از کشف ساختار هموگلوبین و میوگلوبین در دهه ۱۹۵۰ تا انقلاب AlphaFold در عصر حاضر، مطالعات ساختاری پیوسته به پیشرفت علوم زیستی و پزشکی کمک شایانی کردهاند. هرچند فناوریها و رویکردها متحول شدهاند، اما اصل محوری “ارتباط ساختار و عملکرد” همچنان پابرجاست. در عصر پساژنومیک، که توالیهای ژنومی بیشماری در دسترس قرار دارند، تفسیر این دادهها در چارچوب ساختار و عملکرد پروتئینها ضروریتر از همیشه است.
شناخت عمیق از اصول تاخوردگی پروتئینها و روابط تکاملی آنها، امکان پیشبینی و طراحی هدفمند را فراهم میکند. از دیدگاه آموزشی، درک جامع ساختار پروتئینها پایهای ضروری برای دانشجویان و محققان علوم زیستی است. این دانش نه تنها برای متخصصان بیوشیمی و بیوفیزیک، بلکه برای محققان حوزههای پزشکی، داروسازی، بیوتکنولوژی و حتی هوش مصنوعی اهمیت دارد. دوره بیوانفورماتیک پروتئین یک فرصت طلایی برای رسیدن به درک جامع از ساختار پروتئینها است.
در پایان، مطالعه ساختار پروتئینها بیش از یک موضوع آکادمیک صرف است؛ این حوزه مرزی است میان کشف بنیادی و کاربرد عملی، جایی که دانش آکادمیک به نوآوریهایی تبدیل میشود که زندگی انسانها را بهبود میبخشد. با توجه به پیشرفتهای شتابان در فناوریهای تجربی و محاسباتی، میتوان پیشبینی کرد که آینده این حوزه به همان اندازه هیجانانگیز و تحولآفرین خواهد بود که گذشته آن بوده است.
جدیدترین اخبار را در کانال لینکدین گروه بیوانفورماتیک وانیار دنبال کنید.
پروتئینها ماکرومولکولهایی هستند که از آمینواسیدها تشکیل شدهاند و وظایف حیاتی مانند کاتالیز واکنشهای شیمیایی، انتقال مواد، و تنظیم فرآیندهای زیستی را انجام میدهند. مطالعه ساختار پروتئینها برای درک عملکرد آنها، طراحی داروها، و درمان بیماریهای مرتبط با نقص پروتئینی ضروری است.
ساختار پروتئین به چهار سطح تقسیم میشود:
اولیه: توالی خطی اسیدهای آمینه.
ثانویه: الگوهای محلی مانند مارپیچ آلفا و صفحات بتا.
ساختار سوم: آرایش سهبعدی کامل زنجیره پلیپپتیدی.
ساختار چهارم: تجمع چندین زنجیره پلیپپتیدی (زیرواحدها).
عوامل محیطی مانند pH، دما، غلظت نمک، و حضور مولکولهای دیگر بر فرآیند تاخوردگی پروتئینها تأثیرگذارند. همچنین، برهمکنشهای آبگریز، پیوندهای هیدروژنی، پیوندهای دیسولفیدی، و نیروهای واندروالس نقش مهمی در پایداری ساختار پروتئین دارند.
سه روش اصلی برای تعیین ساختار پروتئینها عبارتند از:
کریستالوگرافی اشعه ایکس: مناسب برای پروتئینهای کریستاله.
طیفسنجی NMR: مناسب برای پروتئینهای کوچک در محلول.
میکروسکوپ الکترونی کرایو (Cryo-EM): مناسب برای کمپلکسهای بزرگ و پروتئینهای غشایی.
پروتئینهای بینظم ذاتی فاقد ساختار سهبعدی پایدار هستند و به دلیل انعطافپذیری بالا، نقشهای تنظیمی و سیگنالدهی مهمی ایفا میکنند. در مقابل، پروتئینهای معمولی دارای ساختار سهبعدی مشخصی هستند که برای عملکرد آنها ضروری است.
مهندسی پروتئین فرآیند طراحی و تغییر پروتئینها برای بهبود خصوصیات یا ایجاد عملکردهای جدید است. این فناوری در صنایع غذایی، پزشکی، و زیستفناوری کاربردهای گستردهای دارد، مانند طراحی آنزیمهای پایدارتر یا پروتئینهای درمانی.

تیم تولید محتوای گروه بیوانفورماتیک وانیار در تلاش است تا بهترین آموزشهای کوتاه در زمینه بیوانفورماتیک و زیستشناسی را تهیه نماید. صحت محتوای این صفحه توسط کارشناسان گروه بیوانفورماتیک وانیار بررسی شده است.
عضویت در مجله وانیار
جدید ترین مقالات در ایمیل شما!
با عضویت در مجله بیوانفورماتیک وانیار ، برترین مقالات را در ایمیل خود دریافت کنید.
سلام، وقت بخیر.
چطور میتونیم بهتون کمک کنیم؟ 🤓
تیم ما آماده پاسخگویی به سوالات شماست.
پشتیبانی 24 ساعته در 7 روز هفته.