پیش ثبتنام دوره NGS بالینی آغاز شد …

ابتدا قصد داریم به این موضوع بپردازیم که RT PCR مخفف Real Time PCR نیست 😎
در بسیاری از آزمایشگاههای مولکولی و متون آکادمیک، روشهای RT-PCR و Real-time PCR بهدلیل شباهت حروفچینی «RT» و کاربردهای نزدیک، بهاشتباه یکسان فرض میشوند. برای رفع این سردرگمی، دستورالعملهای MIQE (منتشرشده در Clinical Chemistry | سال ۲۰۰۹) در بند ۱.۱ خود تأکید میکنند که:
این نامگذاری استاندارد باعث افزایش شفافیت در گزارش نتایج، جلوگیری از ابهام در تفسیر دادههای فلورسانس و تضمین رعایت کنترلهای کیفی میشود.
در ادامه مقاله، شما را بیشتر با تکنیک RT-PCR و تکنولوژی ریل تایم آشنا میکنیم.
آنزیم ترانسکریپتاز معکوس (Reverse Transcriptase) در سال ۱۹۷۰ کشف شد و همین موضوع زمینه را برای توسعه تکنیک PCR رونویسی معکوس (RT-PCR) فراهم کرد. در RT-PCR از RNA بهعنوان الگویی برای تولید DNA مکمل یا cDNA استفاده میشود؛ درواقع به این صورت که با اثردهی آنزیم ترانسکریپتاز معکوس روی RNA، یک کپی تک رشتهای از DNA یعنی cDNA تولید میشود و سپس همین cDNA میتواند توسط یک DNA پلیمراز تکثیر شده و DNA دو رشتهای تولید شود. از اینجا بهبعد، یک فرایند تکثیر مبتنی بر PCR استاندارد داریم.
تکنیک RT-PCR میتواند برای شناسایی انواع RNA شامل mRNA ،rRNA ،microRNA و RNAهای طویل غیرکدکننده (lncRNA) استفاده شود.
⭕ در صورتی که مطالعه شما روی مولکول RNA از نوع کیفی (qualitative) باشد، به آن End-point RT-PCR میگوییم و هیچ پایش فلورسانس در حین واکنش انجام نمیگیرد. این تکنیک برای تشخیص حضور RNA در نمونههای زیستی استفاده میشود و امکان بررسی وجود/عدم وجود ویروسها یا بیان/عدم بیان ژنهای خاص را فراهم میکند. به این منظور، محصول RT-PCR را روی ژل ران کرده و حضور یا عدم حضور توالی هدف را بررسی میکنیم.
از انواع کاربرد End-point RT-PCR، میتوان به موارد زیر اشاره کرد:
⭕ اگر مطالعه شما روی RNA بهصورت کمی (quantitative) باشد، لازم است بعد از ساخت cDNA با آنزیم RT، از تکنولوژی Real-time بهره ببرید. در این صورت، از RT-qPCR به معنای Quantitative Reverse Transcription PCR استفاده کردهاید، یعنی تبدیل RNA به cDNA (مرحله RT) و سپس تکثیر و اندازهگیری کمی cDNA در دستگاه ریل تایم.
RT-qPCR بهدلیل ویژگی کمی و حساسیت بالا در موارد زیر کاربرد گستردهای دارد:
تحلیل دقیق بیان ژن در شرایط مختلف – مانند تغییرات بیان ژن در پاسخ به داروها، شرایط استرسی، و بیماریها.
مطالعات سینتیک و بار ویروسی – تکنیک RT-qPCR میتواند مقدار ویروس را در نمونه اندازهگیری کند، نه فقط حضور یا عدم حضور آن را.
اعتبارسنجی دیتای RNA-seq و Microarray – برای هر مطالعه RNA-seq یا میکرواری، توصیه میشود حداقل ۵ تا ۱۰ ژن DE (یعنی ژنی که در آنالیز دادهها، اختلاف معناداری در سطح بیانش بین دو یا چند گروه پیدا شده) با RT-qPCR اعتبارسنجی شوند تا قابلیت اعتماد به نتایج افزایش یابد.
ریل تایم PCR یک اصطلاح کلی است و به هر روش PCR اشاره میکند که در آن پیشرفت واکنش (تکثیر DNA) در زمان واقعی مانیتور میشود. به این معنا که ما فرآیند تکثیر DNA را در لحظه، در هر سیکل، رصد میکنیم و برای این منظور از رنگهای فلورسنت یا پروب استفاده میکنیم.
نتایج ریل تایم میتواند هم بهصورت کیفی (حضور یا عدم حضور یک توالی) و هم کمی باشد، اما از آنجا که در اکثر مواقع از Real-time PCR برای اندازهگیری کمی استفاده میشود، دو اصطلاح qPCR (به معنی PCR کمی) و Real-time PCR در عمل مترادف شدهاند.
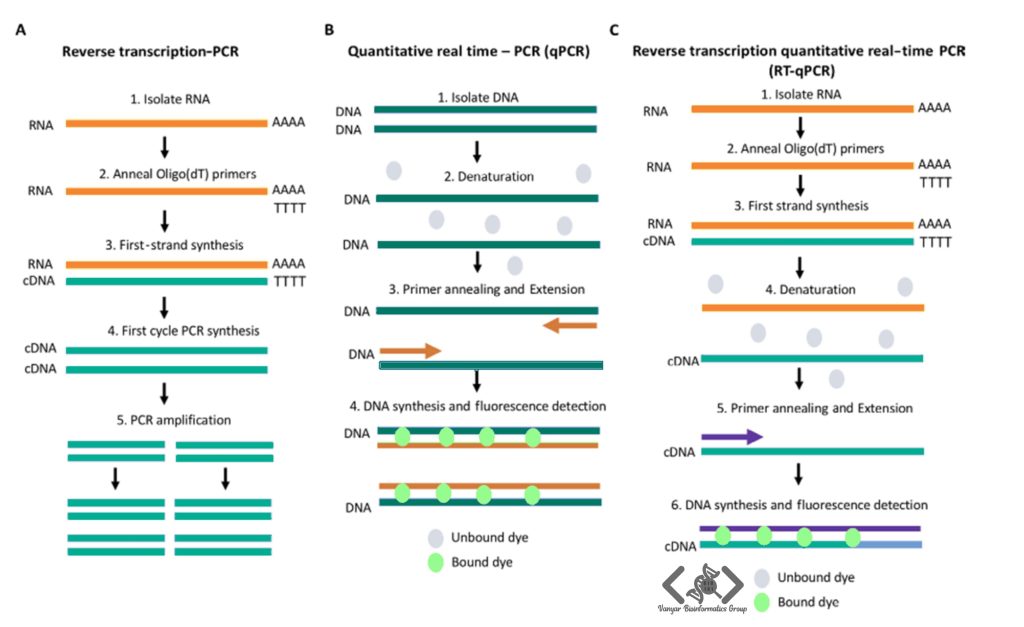
تکنولوژی ریل تایم از روشهای مختلفی برای تشخیص و اندازهگیری DNA در لحظه استفاده میکند که بر پایه سیگنالهای فلورسنت عمل میکنند. این تکنیکها شامل پروبها و رنگهای فلورسنتی هستند که در طول واکنش PCR سیگنال تولید کرده و توسط دستگاه Real-Time PCR شناسایی میشوند.
پیشنهاد: دوره جامع طراحی پرایمر یک فرصت طلایی برای یادگیری طراحی پرایمر به صورت حرفهای در روشهای RT-PCR و ریل تایم است. فرصتی بینظیر جهت فراگیری طراحی پرایمر برای انواع روشهای PCR 😊

چند نمونه از روشهای تشخیص در Real-Time PCR عبارتند از:
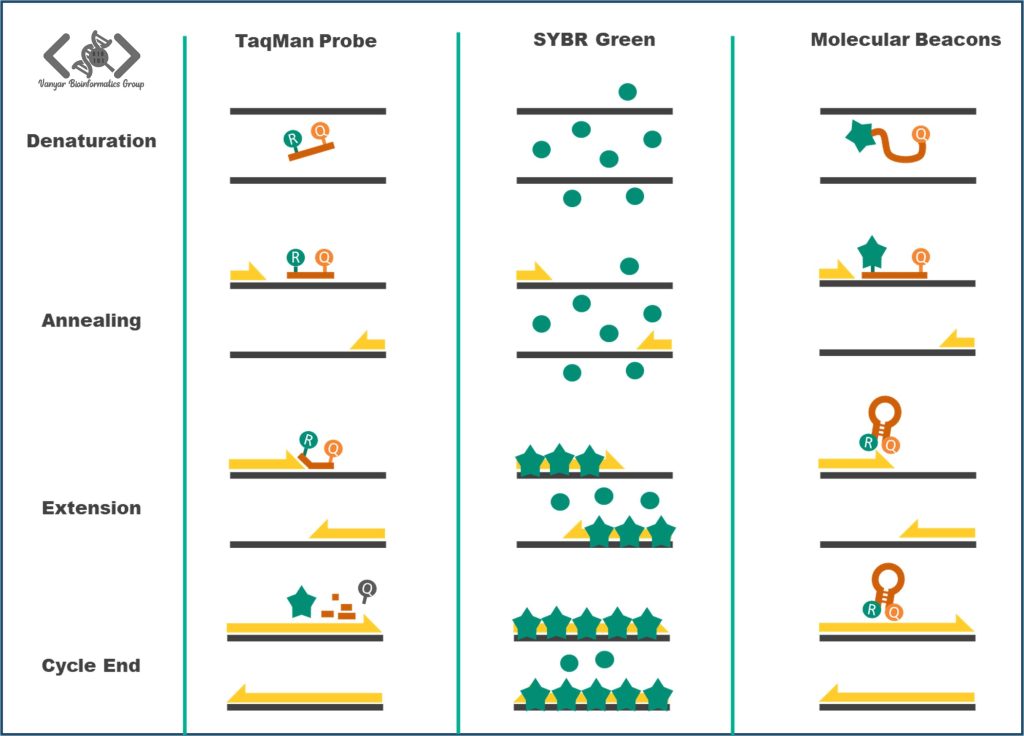
الیگونوکلئوتیدهایی هستند که با رنگ گزارشگر فلورسنت (Reporter یا R) در یک انتها و رنگ خاموشکننده (Quencher یا Q) در انتهای دیگر برچسبگذاری شدهاند. پروب در طی واکنش PCR به ناحیه خاصی از DNA هدف هیبرید یا متصل میشود. هنگامی که پروب توسط آنزیم پلیمراز در طول مرحله گسترش (Extension) شکافته میشود، رنگ R از Q جدا شده و نور فلورسانس منتشر میکند که میتواند توسط دستگاه تشخیص داده شود. مقدار فلورسانس با مقدار DNA هدف متناسب است.
سایبرگرین یک رنگ فلورسنت است که به DNA دو رشتهای (dsDNA) متصل میشود. در طی واکنش PCR، هرچقدر که میزان بیشتری dsDNA تولید شود، SYBR Green بیشتری هم به آن متصل شده و نور فلورسانس بیشتری هم منتشر میشود. بنابراین، مقدار فلورسانس با مقدار dsDNA متناسب است. با این حال، SYBR Green نمیتواند بین محصولات اختصاصی و غیراختصاصی تمایز قائل شود، بنابراین برای تأیید اختصاصیت تکثیر، آنالیز منحنی ذوب (Melting Curve) مورد نیاز است.
فانوسهای مولکولی پروبهای اولیگونوکلئوتیدی هستند که یک ساختار سنجاقسر را با یک رنگ گزارشگر در یک سر و یک رنگ خاموشکننده در انتهای دیگر تشکیل میدهند. پروب هنگامی که در این کانفورماسیون قرار دارد، نور فلورسانس منتشر نمیکند. با این حال، هنگامی که پروب در طول واکنش PCR به DNA هدف هیبرید میشود، ساختار آن باز شده و رنگ گزارشگر را از رنگ خاموشکننده جدا میکند و در نتیجه سیگنال فلورسانس میتواند توسط دستگاه تشخیص داده شود. مقدار نور فلورسانس با مقدار DNA هدف متناسب است.
در طول فاز Denaturation، فانوس مولکولی از ساختار Hairpin خود باز شده و به یک حالت تصادفی (Random Coil) درمیآید. در این فاز بهدلیل دمای بالا و عدم هیبرید شدن به DNA هدف، سیگنال فلورسانس قوی نداریم. پس از هیبریداسیون فانوس مولکولی با هدف در مرحله Annealing، رنگ R و Q از هم جدا میشوند و رنگ گزارشگر فلورسانس ساطع میکند. فانوسهای مولکولی بر خلاف پروبهای TaqMan، در طول واکنش تکثیری دست نخورده باقی میمانند.
در بخشهای قبلی این مقاله، درباره RT-qPCR صحبت کردیم، روشی که طی آن ابتدا RNA را با آنزیم RT به cDNA تبدیل میکنیم و سپس روی آن با تکنیک ریل تایم سنجش کمی انجام میدهیم. اما در روش qPCR (بدون RT) سنجش کمی روی مولکول DNA انجام میشود و نیازی به استفاده از آنزیم RT نیست.
روش qPCR برای اندازهگیری دقیق تعداد نسخههای DNA (مانند تشخیص تغییرات تعداد کپی (CNVs) در نمونه) استفاده میشود و به پژوهشگران امکان تحلیل کمی DNA را میدهد.
تکنیسینها qPCR را بهمنظور بررسی اضافه یا حذف شدن نواحی خاصی از ژنوم (بهطور مثال: اگزونها) به کار میبرند، مانند: بررسی افزایش تعداد کپی ژن HER2 در سرطان پستان.
از برخی جهات، معیارهای طراحی پرایمر در RT-PCR (کیفی و کمی) و qPCR مشابه PCR استاندارد یا معمولی هستند، مانند طول پرایمر (معمولاً ۱۸ تا ۲۳ نوکلئوتید)، درصد GC (محدوده ۴۰ تا ۶۰ درصد)، پرهیز از ساختارهای دایمر و … . توصیه میکنیم به این منظور، مقاله “طراحی پرایمر چیست؟” را مطالعه کنید.
در ادامه این مقاله، مروری بر معیارها و استراتژیهای طراحی پرایمر برای تکنیکهای RT-PCR و Real-time PCR خواهیم داشت.
چالش اساسی تکنیسینها برای اجرای RT-PCR، وجود DNA ژنومی (gDNA) هنگام استخراج RNA از نمونه است (آلودگی gDNA). دو راهکار برای حذف gDNA از نمونه وجود دارد: استفاده از DNase برای شکستن DNA و طراحی پرایمرهایی که بین cDNA و gDNA تمایز قائل میشوند.
در ادامه، استراتژیهای طراحی پرایمر را در تکنیک RT-PCR به شما معرفی میکنیم.
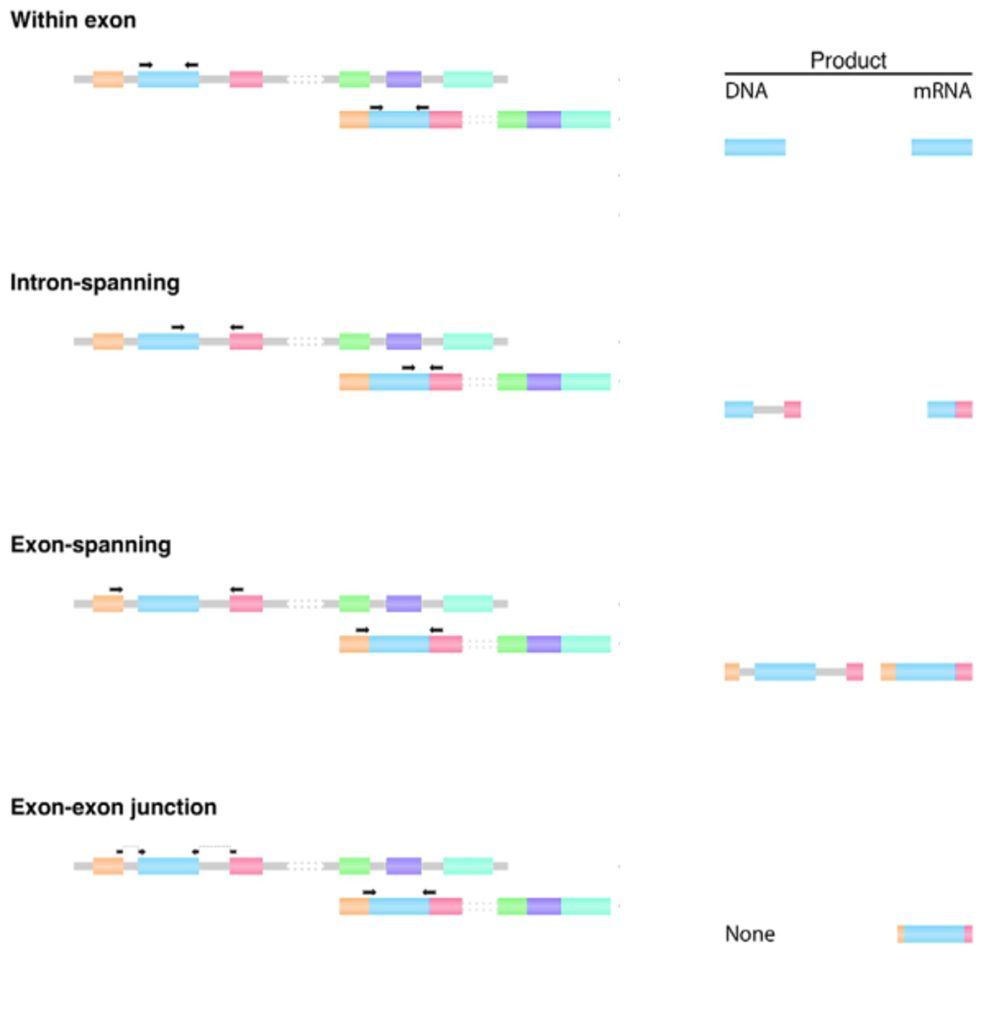
در این حالت هر دو پرایمر Forward و Reverse در یک اگزون قرار دارند که موجب تکثیر غیرقابل افتراق محصولات cDNA و gDNA خواهد شد. تصور کنید ژن مورد نظر شما اصلاً بیان نشده و RNA آن در نمونه وجود ندارد. اگر در این شرایط آلودگی gDNA داشته باشید، پرایمرها به DNA وصل شده و تکثیر رخ میدهد. اینجاست که به اشتباه نتیجه میگیرید ژن شما بیان دارد.
پرایمرها روی دو اگزون جداگانه قرار گرفتهاند و بین آنها اینترون است. در این حالت، علاوه بر یک محصول PCR با اندازه cDNA مورد انتظار، اگر اندازه اینترون بین دو اگزون بهاندازه کافی کوچک باشد، امپلیکون بلندتری از gDNA (نسبت به cDNA) تولید میشود.
پرایمرها روی دو اگزون مختلف قرار میگیرند که حداقل با یک اگزون و دو اینترون از هم جدا شدهاند.
پرایمر Forward یا Reverse در محل اتصال بین دو اگزون قرار دارد، در حالی که پرایمر دوم ممکن است بهطور کامل در داخل یک اگزون یا در یک اتصال اگزون به اگزون دیگر قرار بگیرد. توالیهایی از cDNA اما نه از gDNA با این استراتژی تکثیر خواهند شد.
🟥 توجه کنید که اگر قصد دارید از روش RT-PCR اندپوینت استفاده کنید، میتوانید بهراحتی محصولات تا سایز 1000bp را تولید کنید. حتی با استفاده از کیتها و آنزیمهای مناسب قادر به تولید امپلیکونهای چند کیلوبایتی نیز هستید.
🟧 اما در صورتیکه قصد دارید از تکنولوژی Real-time بهمنظور سنجش کمی بیان ژن استفاده کنید (RT-qPCR)، بهشدت توصیه میشود که سایز محصول کوتاه (زیر 300bp) و Tm بین ۶۰ تا ۶۵ درجه (با اختلاف حداکثر دو درجه) باشد. دلیل این موضوع هم این است که در ریلتایم، سیگنال فلورسانس باید سریع و دقیق تشخیص داده شود و طولانی بودن محصول باعث کاهش کارایی واکنش (efficiency)، افت حساسیت و افزایش احتمال تولید محصولات غیراختصاصی میشود.
در qPCR، مولکول ورودی مستقیما DNA است، در حالی که در RT-PCR اند-پوینت و RT-qPCR ابتدا RNA را به cDNA تبدیل میکنیم؛ بنابراین به حذف gDNA در qPCR نیاز نداریم.
سایر اصول طراحی پرایمر با روش RT-qPCR مشترکاند و اندازهی امپلیکون برای حفظ بازده نزدیک به 100٪ و سیگنال دقیق، زیر 300bp، مشابه RT-qPCR توصیه میشود.
🟦 هنگام استفاده از پروب فلورسنت در تکنیکهای کمی مانند qPCR یا RT-qPCR، باید پروب را بهگونهای طراحی کرد که بهصورت اختصاصی به توالی هدف متصل شود تا سیگنالی دقیق و قابل اعتماد تولید گردد. یکی از نکات کلیدی در این طراحی، آن است که دمای ذوب پروب (Tm) معمولاً ۵ تا ۱۰ درجه سلسیوس بالاتر از پرایمرها باشد، تا اتصال پایدار و مؤثری پیش از اتصال پرایمرها برقرار شود.
در RT-PCR اندپوینت (کیفی)، آنالیز دیتا ساده است: محصول PCR روی ژل آگارز ران شده و با رنگ DNA مثل اتیدیوم بروماید مشاهده میشود. درواقع، فقط حضور یا عدم حضور باند (و اندازهاش) را بررسی میکنیم، پس تحلیل فقط کیفی است (بیان شده یا خیر).
اما در qPCR و RT-qPCR (تکنیکهای کمی)، آنالیز دقیقتری نیاز داریم. در اینجا دستگاه Real-time PCR در هر سیکل، مقدار فلورسانس را اندازهگیری میکند. مهمترین دادهای که از دستگاه میگیریم، Ct یا (Cycle threshold) است: تعداد سیکلی که در آن سیگنال از آستانه عبور میکند و بهصورت معنیدار ثبت میشود.
برای تحلیل، معمولاً:
در نهایت، دادهها بهصورت نمودار و Fold Change تفسیر میشوند، و صحت نتایج را باید با کنترلها تأیید نمایید.
در این مقاله، با نگاهی ساده اما علمی، تفاوتهای کلیدی میان RT-PCR (مبتنی بر تبدیل معکوس RNA به cDNA) و Real-time PCR (با پایش لحظهای فلورسانس و قابلیت اجرا روی DNA/RNA) را شفافسازی کردیم. همچنین نشان دادیم که ترکیب این دو تکنیک، یعنی RT-qPCR، چگونه به یک ابزار دقیق در پژوهشهای سنجش میزان بیان ژن تبدیل شده است. در ادامه نیز اصول طراحی پرایمر برای این روشها را با تأکید بر پارامترهایی همچون اندازه امپلیکون، دمای ذوب، و راندمان واکنش مرور کردیم. آشنایی با این مفاهیم، گامی ضروری برای طراحی آزمایشهای دقیق، تکرارپذیر و قابل استناد است.
اگه تجربه پیادهسازی این تکنیکهای آزمایشگاهی رو داشتی، خوشحال میشیم با ما در بخش نظرات به اشتراک بگذاری 🙂
Real-time PCR به هر روش PCR گفته میشود که در آن با اندازهگیری فلورسانسِ حاصل از رنگها یا پروبهای اختصاصی در هر چرخه، فرآیند تکثیر لحظهبهلحظه پایش میشود؛ در عمل وقتی هدف مطالعه، آنالیز کمی باشد، به آن qPCR یا quantitative PCR هم گفته میشود.
qPCR یا quantitative PCR، روشی است که در آن با استفاده از نشانگر فلورسنت (مثل SYBR Green یا پروبها) تکثیر DNA در هر چرخه رصد میشود تا بتوان مقدار دقیق DNA هدف را تعیین کرد (سنجش کمی). از آنجا که در اکثر مواقع از Real-time PCR برای اندازهگیری کمی استفاده میشود، دو اصطلاح qPCR و Real-time PCR در عمل مترادف شدهاند.
نتایج ریل تایم میتواند هم بهصورت کیفی (حضور یا عدم حضور یک توالی) و هم کمی باشد. اما از آنجا که در اکثر مواقع از ریل تایم برای اندازهگیری کمی استفاده میشود، دو اصطلاح qPCR (به معنی PCR کمی) و Real-time PCR عملا با هم مترادف هستند.
RT-PCR تکنیکی است که در آن از آنزیم Reverse Transcriptase برای تبدیل مولکولهای RNA به cDNA استفاده میشود. در مرحله بعد میتوان با واکنش PCR اند-پوینت، DNA را تکثیر و با الکتروفورز ژل محصول را کیفیسازی کرد، یا اینکه میتوان مستقیماً cDNA تولیدشده را در یک واکنش ریل تایم بهکار برد تا میزان بیان ژن را کمیسازی کرد.
RT-qPCR یا Quantitative Reverse Transcription PCR ترکیبی از RT و qPCR است؛ یعنی ابتدا RNA به cDNA تبدیل میشود و سپس همان cDNA بهصورت Real-time با سیگنال فلورسنت سنجش و کمّی میگردد.
در RT-qPCR مولکول ورودی RNA است که ابتدا به cDNA تبدیل میشود، اما در qPCR ورودی مستقیماً DNA است و مرحلهی RT ندارد. هر دوی این روشها از تکنولوژی ریل تایم برای کمیسازی نتایج استفاده میکنند.
RT-PCR به واکنشهایی اشاره میکند که مرحلهی معکوسنویسی (با آنزیم RT) دارند و معمولا اند-پوینت هستند. اما Real-time PCR یعنی پایش فلورسانس لحظهای که میتواند روی DNA یا cDNA انجام شود.
پارامترهای طراحی پرایمر در ریل تایم از خیلی جهات (طول پرایمر، محتوای GC و …) مشابه PCR استاندارد یا معمولی هستنند. اما در Real-time PCR توصیه میشود که سایز محصول زیر ۳۰۰bp و Tm بین ۶۰ تا ۶۵ درجه (با اختلاف حداکثر دو درجه) باشد تا بازده و دقت واکنش افزایش یابد. در صورت استفاده از پروب فلورسنت در ریل تایم، دمای Tm آن باید حدود ۵ تا ۱۰ درجه بالاتر از پرایمرها باشد تا اتصال اختصاصی و پایدار تضمین شود.

تیم تولید محتوای گروه بیوانفورماتیک وانیار در تلاش است تا بهترین آموزشهای کوتاه در زمینه بیوانفورماتیک و زیستشناسی را تهیه نماید. صحت محتوای این صفحه توسط کارشناسان گروه بیوانفورماتیک وانیار بررسی شده است.
عضویت در مجله وانیار
جدید ترین مقالات در ایمیل شما!
با عضویت در مجله بیوانفورماتیک وانیار ، برترین مقالات را در ایمیل خود دریافت کنید.
سلام، وقت بخیر.
چطور میتونیم بهتون کمک کنیم؟ 🤓
تیم ما آماده پاسخگویی به سوالات شماست.
پشتیبانی 24 ساعته در 7 روز هفته.